Questões de Concurso Público INPI 2014 para Pesquisador em Propriedade Industrial (Classe A, Padrão I) - Cargo 2
Foram encontradas 4 questões
Ano: 2014
Banca:
CESPE / CEBRASPE
Órgão:
INPI
Prova:
CESPE - 2014 - INPI - Pesquisador em Propriedade Industrial (Classe A, Padrão I) - Cargo 2 |
Q496729
Química
Nas células eletrolíticas, as reações redox que têm energia
livre de reação positiva não são espontâneas, de modo que, por isso,
faz-se necessária corrente elétrica para gerar uma diferença de
potencial maior que a diferença de potencial que seria produzida
pela reação inversa, conforme mostra a figura a seguir.
Os elétrons passam do ânodo para o cátodo, os cátions movem-se através do eletrólito na direção do cátodo e os ânions na direção do ânodo.
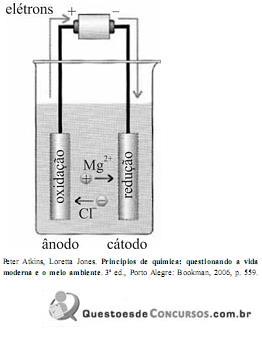
Com base nas informações e na figura acima, julgue o item.
Considerando-se que “fund" significa sal fundido, é correto afirmar que as semirreações correspondentes ao diagrama apresentado na figura acima e as reações ocorridas no ânodo e no cátodo são:
reação do ânodo: Mg2+ (fund) + 2e- → Mg(l);
reação do cátodo: 2Cl- (fund) → Cl2(g) + 2e .
Os elétrons passam do ânodo para o cátodo, os cátions movem-se através do eletrólito na direção do cátodo e os ânions na direção do ânodo.

Com base nas informações e na figura acima, julgue o item.
Considerando-se que “fund" significa sal fundido, é correto afirmar que as semirreações correspondentes ao diagrama apresentado na figura acima e as reações ocorridas no ânodo e no cátodo são:
reação do ânodo: Mg2+ (fund) + 2e- → Mg(l);
reação do cátodo: 2Cl- (fund) → Cl2(g) + 2e .
Ano: 2014
Banca:
CESPE / CEBRASPE
Órgão:
INPI
Prova:
CESPE - 2014 - INPI - Pesquisador em Propriedade Industrial (Classe A, Padrão I) - Cargo 2 |
Q496730
Química
Nas células eletrolíticas, as reações redox que têm energia livre de reação positiva não são espontâneas, de modo que, por isso, faz-se necessária corrente elétrica para gerar uma diferença de potencial maior que a diferença de potencial que seria produzida pela reação inversa, conforme mostra a figura a seguir.
Os elétrons passam do ânodo para o cátodo, os cátions movem-se através do eletrólito na direção do cátodo e os ânions na direção do ânodo.

Com base nas informações e na figura acima, julgue o item.
A galvanização é um método utilizado para prevenir a corrosão de metais, em que um primeiro metal é encoberto por um segundo metal, devendo este segundo, para isso, estar abaixo do primeiro na série eletroquímica, uma vez que, ao sofrer deterioração, o segundo libera seus elétrons para o primeiro. Dessa forma, é correto afirmar que a galvanização é um processo eletroquímico.
Os elétrons passam do ânodo para o cátodo, os cátions movem-se através do eletrólito na direção do cátodo e os ânions na direção do ânodo.

Com base nas informações e na figura acima, julgue o item.
A galvanização é um método utilizado para prevenir a corrosão de metais, em que um primeiro metal é encoberto por um segundo metal, devendo este segundo, para isso, estar abaixo do primeiro na série eletroquímica, uma vez que, ao sofrer deterioração, o segundo libera seus elétrons para o primeiro. Dessa forma, é correto afirmar que a galvanização é um processo eletroquímico.
Ano: 2014
Banca:
CESPE / CEBRASPE
Órgão:
INPI
Prova:
CESPE - 2014 - INPI - Pesquisador em Propriedade Industrial (Classe A, Padrão I) - Cargo 2 |
Q496731
Química
Nas células eletrolíticas, as reações redox que têm energia livre de reação positiva não são espontâneas, de modo que, por isso, faz-se necessária corrente elétrica para gerar uma diferença de potencial maior que a diferença de potencial que seria produzida pela reação inversa, conforme mostra a figura a seguir.
Os elétrons passam do ânodo para o cátodo, os cátions movem-se através do eletrólito na direção do cátodo e os ânions na direção do ânodo.

Com base nas informações e na figura acima, julgue o item.
Na célula eletrolítica apresentada, o magnésio é decantado da água do mar e, então, convertido em cloreto por tratamento com ácido clorídrico. Após a evaporação da água,o MgCl2 é fundido e eletrolisado e a reação global resultante é: MgCl2 → Mg(l) + Cl2(g).
Os elétrons passam do ânodo para o cátodo, os cátions movem-se através do eletrólito na direção do cátodo e os ânions na direção do ânodo.

Com base nas informações e na figura acima, julgue o item.
Na célula eletrolítica apresentada, o magnésio é decantado da água do mar e, então, convertido em cloreto por tratamento com ácido clorídrico. Após a evaporação da água,o MgCl2 é fundido e eletrolisado e a reação global resultante é: MgCl2 → Mg(l) + Cl2(g).
Ano: 2014
Banca:
CESPE / CEBRASPE
Órgão:
INPI
Prova:
CESPE - 2014 - INPI - Pesquisador em Propriedade Industrial (Classe A, Padrão I) - Cargo 2 |
Q496732
Química
Nas células eletrolíticas, as reações redox que têm energia livre de reação positiva não são espontâneas, de modo que, por isso, faz-se necessária corrente elétrica para gerar uma diferença de potencial maior que a diferença de potencial que seria produzida pela reação inversa, conforme mostra a figura a seguir.
Os elétrons passam do ânodo para o cátodo, os cátions movem-se através do eletrólito na direção do cátodo e os ânions na direção do ânodo.

Com base nas informações e na figura acima, julgue o item.
Na célula eletrolítica mostrada na figura, a ponte salina foi removida para que os elétrons fluíssem mais rapidamente do ânodo para o cátodo.
Os elétrons passam do ânodo para o cátodo, os cátions movem-se através do eletrólito na direção do cátodo e os ânions na direção do ânodo.

Com base nas informações e na figura acima, julgue o item.
Na célula eletrolítica mostrada na figura, a ponte salina foi removida para que os elétrons fluíssem mais rapidamente do ânodo para o cátodo.