Questões de Concurso
Sobre bioquímica em biomedicina em biomedicina - análises clínicas
Foram encontradas 1.067 questões
I. A utilização de detecção por fluorescência aumenta o poder de resolução de proteínas em gel, mas é um método laborioso e que introduz a manipulação de reagentes perigosos, que aumentam o risco de exposição e biossegurança nos laboratórios e que detectam apenas uma fração das proteínas presentes nas amostras.
II. A utilização de marcação radioativa é relevante apenas quando estão sendo realizadas análises proteômicas baseadas em modificações pós-traducionais das proteínas.
III. As técnicas de marcação fluorescente e radioativa aumentam o poder de resolução das análises proteômicas, entretanto requerem etapas anteriores de incubação com compostos apropriados.
Assinale:

Com base nestes resultados e nos seus conhecimentos sobre os métodos em questão, observe as afirmativas abaixo, e assinale abaixo a alternativa correta.
I. O método de Folin apresentou uma menor quantificação pois avalia a quantidade de proteínas em função da presença de alguns poucos tipos de aminoácidos que, por serem pouco abundantes na proteína em questão, levou a uma baixa detecção da mesma pelo método.
II. O método de Lowry apresenta diversos tipos de interferência, o que pode ter levado a uma super-estimativa do nível de proteínas presente na fração analisada.
III. O método de Folin, na verdade, não é um método apropriado para a detecção de proteínas, uma vez que avalia a quantidade de açúcares e não de aminoácidos.
IV. O método de Lowry quantifica as ligações peptídicas presentes na proteína avaliada e, desta forma, apresenta uma maior sensibilidade do que o método de Folin que apenas avalia a presença dos aminoácidos tirosina e triptofano.
V. O método de Folin apresenta difícil manipulação e grande variabilidade, o que resulta em uma baixa reprodutibilidade e alta taxa de erro, o que provavelmente resultou em uma sub-estimativa da quantidade de proteínas presentes na amostra.
Assinale:
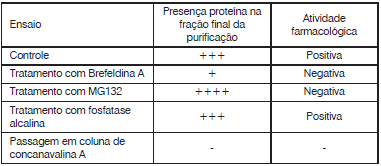
Com base nestes dados o pesquisador optou pela realização dos seguintes passos de purificação: Inicialmente, a mistura foi aplicada em uma coluna de sepharose G50, sendo obtidas, na sequência de eluição, a fração 1 (F1, primeira a ser eluída), e a fração F2. A Fração F2 foi então aplicada em uma coluna de concanavalina. Após a aplicação do tampão de lavagem, foi obtida a fração F3 e, após aplicação do tampão de eluição, obteve-se a fração F4. Submetendo a Fração F3 à uma precipitação em sulfato de amônio, foram então obtidas a fração solúvel (F5) e a fração insolúvel (F6). A aplicação da Fração F1 em uma coluna de Poli-U, seguido da aplicação do tampão de lavagem deu então origem à fração F7 e, após a eluição final, com tampão de eluição, à fração F8.
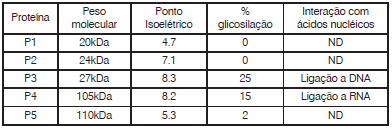
Com base nas características das proteínas, e nos prodecimentos utilizados pelo pesquisador, assinale a alternativa que melhor identifica as frações nas quais cada uma das proteínas sera isolada de forma purificada.

Visando purificar a proteína de interesse farmacológico (Proteína 2), você realizou uma cromatografia de gel filtração. Após acompanhar o perfil de eluição desta cromatografia, você identificou uma sequência de picos, que foram coletados e analisados. Com base nos seus conhecimentos sobre separação de proteínas, assinale a alternativa que melhor corresponde ao i.) número de picos indentificados na análise do cromatograma desta cromatografia; ii.) qual seria o pico que conteria a proteína de interesse; iii) e, no caso de existir a necessidade de passos adicionais em seu protocolo de purificação. Assinale a alternativa que indica uma opção viável de método subsequente a ser utilizado para o isolamento da proteína 2.
I. A adição de ubiquitina acontece sempre de forma específica, em determinados resíduos da cadeia polipeptídica.
II. A adição de ubiquitina acontece sempre de forma sequencial e rápida, de forma que são gerados sempre intermediários protéicos poli-ubiquitinados.
III. A adição de ubiquitina marca a proteína especificamente para a degradação via proteassoma.
IV. A adição de poli-ubiquitina corresponde a uma das formas de controle do tempo de via das proteínas celulares.
Assinale:
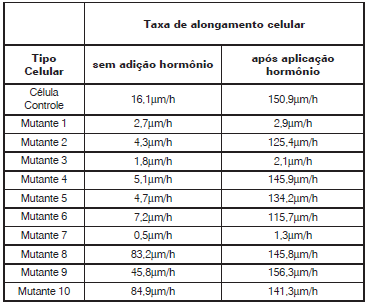
Com base nestes resultados, foram formuladas as seguintes afirmativas.
I. Os mutantes 1, 3 e 7 correspondem aos mutantes na via de transdução de sinal do hormônio.
II. Os mutantes 2, 4, 5 e 6 correspondem aos mutantes na via de biossíntese do hormônio.
III. Os mutantes 1, 3 e 7 correspondem aos mutantes na via de biossíntese do hormônio.
IV. Os mutantes 2, 4, 5 e 6 correspondem aos mutantes na via de transdução de sinal do hormônio.
V. Os mutantes 8, 9 e 10 correspondem a mutantes que produzem níveis elevados do hormônio, mas que não apresentam alteração da sinalização.
Assinale:
I. Massa molecular da proteína 45kDa.
II. Ponto isoelétrico 6,8.
III. Proteína solúvel em metanol.
IV. Proteína com 35% de resíduos de carbohidratos.
V. Proteína ativa apenas na forma fosforilada.
Com base nos resultados, selecione, dentre as alternativas abaixo, a que contém o sistema de expressão mais indicado para a produção de sua proteína, em escala industrial, e com baixo risco de biossegurança, para seu posterior uso no tratamento anti-HIV.