Questões de Concurso
Para nc-ufpr
Foram encontradas 9.464 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Álcoois são funções orgânicas das mais importantes. A função álcool define tanto a propriedade como a reatividade do grupo. A respeito do tema, identifique como verdadeiras (V) ou falsas (F) as seguintes afirmativas:
( ) A solubilidade em água de álcoois primários aumenta com a massa molar.
( ) Fenóis são mais ácidos que álcoois alifáticos.
( ) A oxidação branda de álcoois secundários leva a aldeídos.
( ) A hidroxila é o sítio mais reativo nos álcoois.
Assinale a alternativa que apresenta a sequência correta, de cima para baixo.
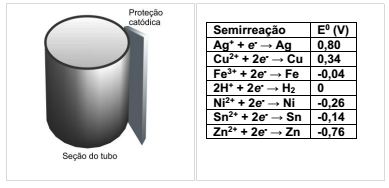
Tubulações de ferro, quando em contato com solo úmido, sofrem pela ação do meio, causando a corrosão da peça. Uma maneira de proteção da tubulação é a proteção catódica, isto é, a utilização de um metal de sacrifício em contato com a tubulação, como esquematizado ao lado:
Entre os metais listados abaixo, o mais adequado para compor a peça de proteção é:
Ao adicionar cloro gasoso sob pressão numa solução alcalina, o cloro se desproporciona em cloreto e hipoclorito, segundo a reação:

Dados: E0 pH 14 (V): Cl2/Cl- = 1,358; ClO- /Cl2 = 0,421; 2,303.RT/F = 0,059.
A ordem de grandeza da constante de equilíbrio da reação de desproporcionamento é:
A gordura trans é formada no processo de hidrogenação da gordura vegetal, sobre catalisador metálico. A gordura vegetal é rica em ácidos graxos insaturados de simetria cis. A equação genérica para o processo de hidrogenação da gordura vegetal é mostrada a seguir.
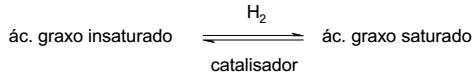
Com base no exposto acima, identifique como verdadeiras (V) ou falsas (F) as seguintes afirmativas:
( ) O catalisador acelera a reação nos dois sentidos e proporciona a formação do isômero mais estável.
( ) O catalisador metálico impede a formação do isômero cis.
( ) O catalisador promove na sua superfície a reação de isomerização.
( ) O ácido graxo insaturado é instável.
Assinale a alternativa que apresenta a sequência correta, de cima para baixo.
Ácido cítrico é um ácido triprótico, cuja primeira constante de acidez é Ka = 7,4 x 10-3 . A uma solução contendo 0,5 mol.L-1 de ácido cítrico, foi adicionado dihidrogenocitrato de sódio, de modo que sua concentração também é de 0,5 mol.L-1 . (Dados: ℓog(7,4) = 0,87.)
O valor de pH da solução final é:
A titulação redox se baseia numa reação de oxirredução entre analito e titulante. A titulação utilizando permanganato de potássio facilita a visualização, porque a solução do íon permanganato possui cor violeta intensa, enquanto que a solução de Mn2+ é quase que incolor. A solução de permanganato pode ser utilizada para titular solução de íons Fe2+ .
Ao se titular uma alíquota de 10 mL de uma solução 1,1 mol.L-1 de Fe2+, o volume esperado de permanganato 0,100 mol.L-1 a ser consumido é de:
Em fevereiro ocorreu um acidente com um caminhão que transportava ácido clorídrico, bloqueando a Rodovia Castello Branco, SP. “Segundo a concessionária, o compartimento que carregava o produto se rompeu, o que provocou vazamento do ácido e liberação de fumaça tóxica”. (Disponível em <http://noticias.uol.com.br/cotidiano/ultimas-noticias/2014/02/18/acidente-com-carreta-que-transportava-acido-bloqueia-a-castello-branco.htm> . Acessado em 18/02/2014).
A fumaça tóxica a que se refere o texto deve-se provavelmente ao/aos:
A separação de misturas é um processo de purificação. Quanto mais apropriado o processo para uma dada mistura, mais eficiente será a sua purificação. Com base no exposto, numere a coluna da direita de acordo com sua correspondência com a coluna da esquerda.
1. Filtração a vácuo em funil de placa porosa.
2. Decantação em funil de separação.
3. Destilação.
4. Cromatografia em coluna de sílica.
( ) Clorofila, carotenoides – solução.
( ) Alumina – suspensão 20%.
( ) Dimetilformamida vencida.
( ) Hexanol:água (1:1).
Assinale a alternativa que apresenta a numeração correta da coluna da direita, de cima para baixo.
Sais de carbonatos são, na maioria, pouco solúveis. Num experimento, foram adicionadas soluções equimolares de cloretos de bário, cálcio, estrôncio, cádmio e cobalto num meio levemente alcalino.
Dados:
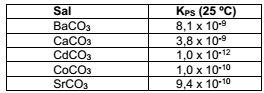
Ao passar do tempo, gás carbônico atmosférico se difunde no meio, causando precipitação de todos os cátions. Após
isso ocorrer, o cátion que estará em maior concentração será o de:
A utilização de sabões facilita a remoção de gordura de pratos e talheres sujos. Os sabões são constituídos de moléculas anfifílicas, que contêm uma porção hidrofílica e uma hidrofóbica que interage com as partículas de gordura, facilitando sua dispersão no meio aquoso. Muitas pessoas constatam que a lavagem com sabão utilizando água quente é mais eficiente que com água fria.
Sobre o tema, considere as seguintes afirmativas:
1. A facilidade de dispersão está relacionada à maior velocidade em água quente, devido à maior frequência de choques entre as partículas de gordura e as moléculas anfifílicas.
2. O processo de dispersão da sujeira envolve interação entre a parte hidrofóbica do anfifílico e a gordura, deixando a parte hidrofílica exposta na superfície que interage com o solvente, formando então uma suspensão.
3. A maior eficiência de lavagem em temperaturas mais altas implica que a reação entre o anfifílico e a sujeira é um processo endotérmico.
4. Em temperaturas superiores à temperatura de fusão de gorduras da sujeira, a velocidade de remoção é aumentada, em função da maior superfície de contato.
Assinale a alternativa correta.
O ciclopropano é utilizado como anestésico. Com aquecimento, esse composto se rearranja em propeno. A constante cinética da reação é k = 5,4 x 10-2 h -1 .
Dado: ℓn(2) = 0,693.
O tempo de meia-vida (em horas) do ciclopropano é:
Os PCBs (policlorobifenil) foram extensivamente utilizados como materiais dielétricos e fluidos refrigerantes em transformadores, capacitores e motores elétricos, devido aos altos valores de capacidade calorífica e temperatura de ebulição. No entanto, os PCBs possuem alta toxicidade. O 3,3’,4,4’-tetraclorobifenil é um PCB bastante comum.
Dados: Cp, 298K: água = 4,18 J.g-1K-1 ; 3,3’,4,4’-tetraclorobifenil = 311 J.mol-1K-1 . M (g.mol-1 ): água = 18; 3,3’,4,4’- tetraclorobifenil = 292. Teb, 1atm (°C): água = 100; 3,3’,4,4’-tetraclorobifenil = 380.
Considerando a mesma quantidade de matéria entre a água e o 3,3’,4,4’-tetraclorobifenil, a variação de temperatura (em ºC) no PCB ao receber a quantidade de calor que provoca uma variação de temperatura de 80 °C na água é de:
Na figura ao lado estão ilustrados gráficos da variação de energia no decorrer da reação para três sistemas independentes: (I), (II) e (III). A e B são espécies distintas em cada caso.
Acerca do exposto, considere as afirmativas a seguir:
1. No caso (I), o excesso de energia é transferido para a vizinhança.
2. A curva (II) corresponde a uma reação isoergônica.
3. A reação (II) necessita da maior energia de ativação dos três casos.
4. A reação (III) pode ocorrer a temperatura ambiente.
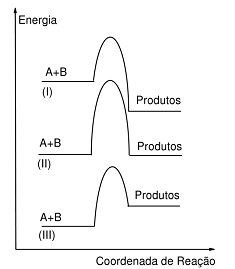
Assinale a alternativa correta.
Misturas são classificadas de acordo com o grau de interação entre as fases e seu estado de agregação. Sobre o tema, numere a coluna da direita de acordo com sua correspondência com a coluna da esquerda.
1. Emulsão.
2. Gel.
3. Sol.
4. Solução coloidal.
( ) Hidróxido de cobre hidratado.
( ) Tinta para parede (líquida no galão).
( ) Água natural rica em ácidos húmicos.
( ) Manteiga.
Assinale a alternativa que apresenta a numeração correta da coluna da direita, de cima para baixo.
O etilenoglicol é largamente utilizado como anticongelante automotivo. A temperatura de congelamento, isto é, a temperatura de equilíbrio entre a fase líquida e a sólida diminui na presença de um soluto em relação a um solvente puro.
Dado: Kf = 1,86 ºC.kg.mol-1 .
Para que a temperatura do líquido seja diminuída em aproximadamente 7,5 ºC, a concentração molal de etileno glicol deverá ser de:
A titulação ácido-base é uma das operações mais corriqueiras de um laboratório de análises. Para se preparar e acondicionar uma solução titulante padronizada de hidróxido de sódio, alguns procedimentos são necessários. Acerca da necessidade do procedimento para preparação da solução mencionada acima, considere as seguintes afirmativas:
1. É necessário pesar a massa de hidróxido de sódio sólido em balança analítica.
2. É necessário utilizar balão volumétrico previamente aferido.
3. É necessário pesar biftalato de potássio seco em balança analítica.
4. É necessário utilizar um frasco plástico para armazenamento.
Assinale a alternativa correta.
A determinação da concentração de íons cloreto em águas é um importante parâmetro para se medir sua qualidade. Íons cloreto reagem com íons prata, gerando o cloreto de prata insolúvel.
Dados: M (g.mol-1 ): Ag = 108; Cl = 35,5; N = 14; O = 16.
A partir da estequiometria da reação de precipitação do cloreto de prata, a massa de nitrato de prata necessária para reagir com 250 mL de uma amostra contendo 250 mg.L-1 de íons cloreto é:
A classificação e separação das espécies segundo sua função química é uma das atribuições do técnico responsável por um laboratório. Os rótulos nos reagentes importados contêm os nomes originais dos produtos. Nesse sentido, numere a coluna da direita com base na informação contida no rótulo do produto mostrada na coluna da esquerda.
1. Phosphorus pentoxide.
2. Trifluoromethanesulfonic acid, reagent grade.
3. n-Butyllithium solution.
4. Ammonium hexafluorophosphate.
( ) Sal.
( ) Ácido.
( ) Óxido.
( ) Base.
Assinale a alternativa que apresenta a numeração correta da coluna da direita, de cima para baixo.
O íon nitrato é um ânion poliatômico. Possíveis estruturas de Lewis são construídas a partir da fórmula NO3- , como mostradas a seguir:
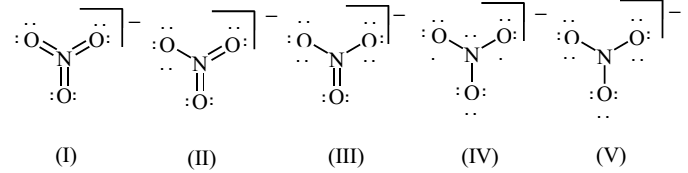
A fórmula de Lewis correta e mais estável do íon nitrato é: