Questões de Concurso
Foram encontradas 8.712 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
A decomposição por aquecimento de certa mistura contendo CaCO3, NaHCO3 e material inerte não volátil produz gases e 640g de resíduo seco. Sabendo-se que a quantidade de calor absorvida na decomposição é 298 kcal, a percentagem de material inerte presente na mistura inicial é de:
Dados:
-Na=23 // Ca=40.
-Calores de decomposição do:
a) CaCO3 = 44,0 kcal.
b) NaHCO3 = 15,5 kcal com formação de H2O(g).
Avalie as afirmativas abaixo.
I A reação química entre metanal e cloreto de metil-magnésio seguido de hidrólise fornece como produto orgânico o propanol.
II Reagindo propan-2-ol com permanganato de potássio e ácido sulfúrico em condições de reagir, fornece como produto principal a propanal.
III A reação do etano como gás cloro na presença de luz ultravioleta formará como produto o cloro-etano.
IV Para se obter nitrobenzeno pode-se reagir benzeno com uma mistura nitrante.
Das afirmativas acima, estão corretas, apenas:
Foram preparados cinco padrões de fosfato dissolvido (P-PO4 3-) e uma prova em branco. Suas absorbâncias foram lidas utilizando uma cubeta com trajeto óptico (TO) de 10 mm, num espectrofotômetro na faixa da luz visível, sendo apresentadas no quadro abaixo (curva de calibração). Ao analisar uma amostra de água, obteve-se uma absorbância de 0,028.
Utilizando as fórmulas abaixo, os valores de a (intersecção da curva de calibração dos eixos x e y), B (declividade da curva de calibração) e a concentração em µM de P-PO43-, na amostra de água analisada, são, respectivamente: Curva de calibração

Em que:
x= concentração dos padrões
y= absorbância dos padrões
N= Número de padrões mais a prova em branco
Em relação à análise de nitrato dissolvido em água, que se fundamenta na dosagem do íon nitrito obtido por redução quantitativa dos íons nitratos presentes na amostra, considere as seguintes afirmativas:
I. A transformação do íon NO3- em NO2- envolve uma reação de oxidação, em que são envolvidos três elétrons, e assim o N passa da valência 5+ para 2+ .
II. A redução do NO3- é efetuada mediante a passagem da amostra por uma coluna redutora preenchida com grãos de cádmio tratados com solução cúprica.
III. A reação de redução independe do metal usado no redutor do pH da solução e da atividade da superfície do metal.
IV. O cádmio presente na coluna gradativamente consumido durante a passagem da amostra pode perder sua eficiência de redução durante grandes pausas de utilização da coluna redutora.
V. Uma solução de NH4Cℓ é utilizada como tamponante, complexante e ativadora do sistema redox, na coluna redutora.
Assinale a alternativa que apresenta as afirmativas corretas.
São apresentadas proposições a respeito das técnicas de espectrometria atômica e molecular:
I. A lâmpada de cátodo oco é empregada nas espectrometrias de absorção atômica e de emissão atômica.
II. As cubetas de quartzo empregadas na espectrofotometria UV/VIS são as mais adequadas para análises quando λ > 390 nm.
III. Uma lâmpada de tungstênio (W) é a fonte de radiação contínua mais comum para a região do visível na espectrofotometria.
IV. Por ser uma técnica espectrométrica, o princípio da espectrometria de emissão atômica em chama (ou fotometria de chama) está baseado na lei de BeerLambert.
V. A lâmpada de deutério (2H) é comumente utilizada como corretor de fundo na análise espectrométrica de absorção atômica.
Assinale a alternativa correta:
Quanto à determinação do pH com o uso de eletrodo de vidro combinado, são feitas as seguintes afirmativas:
I. O eletrodo adequado para medidas de pH mede o potencial que se desenvolve através de uma fina membrana de vidro que separa duas soluções com diferentes concentrações do íon hidrogênio.
II. O eletrodo de referência gera uma tensão elétrica constante que não depende do pH.
III. O eletrodo de referência é constituído de um material inerte (vidro). A membrana desse eletrodo, que tem geralmente a forma de um bulbo, é feita a partir de um vidro especial.
IV. Os eletrodos são construídos com metais inertes, tais como: platina, ouro, paládio.
V. Em soluções com valores de pH abaixo de 0,5, o eletrodo de vidro típico exibe um erro de sinal oposto ao do erro alcalino.
Assinale a alternativa que apresenta a(s) afirmativa(s) INCORRETA(S).
A Resolução n.º 357, do Conselho Nacional do Meio Ambiente (CONAMA, 2005), dispõe sobre a classificação dos corpos de água e diretrizes ambientais para o seu enquadramento, bem como estabelece as condições e padrões de lançamento de efluentes, e dá outras providências. O quadro a seguir, para as águas salobras de Classe 1, indica alguns dos parâmetros inorgânicos e suas concentrações máximas.
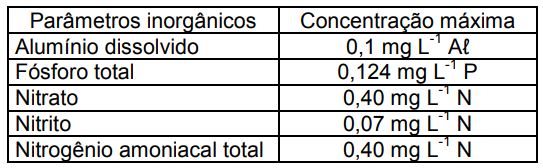
Transformando a unidade do nitrato para µM de N-NO3- e do nitrogênio amoniacal total para µM de N-NH4+ , as concentrações obtidas para a tabela acima são, respectivamente:
Dado: Massa atômica (g mol-1) N= 14,01; O= 16,00 e H=
1,01.
Em uma amostra contendo 1 L de água do mar, dissolvem-se 35 g de sacarose. Em relação à consequência desse acréscimo de sacarose, são feitas as seguintes afirmações:
I. A pressão de vapor da água diminui.
II. A pressão osmótica da solução aumenta.
III. A salinidade permanece praticamente a mesma.
IV. A temperatura de solidificação é alterada.
V. O grau de dissociação dos sais presentes na água permanecerá praticamente o mesmo.
Das afirmações acima, estão corretas:
A descarga de água subterrânea (Submarine Groundwater Discharge – SGD) tem sido considerada um importante elo entre o continente e o oceano, pois, além de carrear uma parcela considerável de água doce, a SGD é uma importante fonte de elementos para a zona costeira. Traçadores geoquímicos naturais, como o rádio (Ra), tem sido considerados uma excelente ferramenta para estudos que envolvam esse processo, pois, além das águas subterrâneas serem enriquecidas por esse elemento, este apresenta comportamento conservativo e suas constantes de decaimento permitem relações que possibilitam a estimativa dos fluxos subterrâneos. Os isótopos do rádio (223Ra, 224Ra, 226Ra e 228Ra) possuem tempos de meia-vida, respectivamente, iguais a:
Dados: Constantes de decaimento 223Ra= 0,06 dias-1; 224Ra= 0,19 dias-1; 226Ra= 0,43 10-3 anos-1 e 228Ra= 0,12 anos-1 .
Fórmula: λ = 0,693 / t½
Em que:
λ = Constante de decaimento
t½ = Tempo de meia-vida
Em relação ao uso e aferição das figuras abaixo, marque V para as alternativas verdadeiras e F para as falsas.
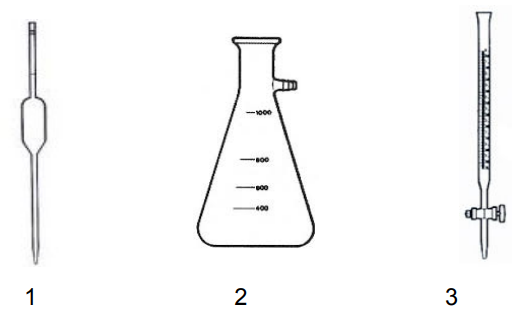
( ) A pipeta volumétrica (figura 1) é um instrumento que permite a medição a transferência de volumes variáveis de líquidos.
( ) A figura 3 é uma bureta, que é um instrumento cilíndrico, de vidro, colocado na vertical com a ajuda de um suporte universal, contendo uma escala graduada rigorosa, geralmente em mL.
( ) A figura 2 é um erlenmeyer, um instrumento ideal para armazenar e misturar soluções, fazer cultivo de organismos e tecidos e é predominantemente usado em titulações.
( ) A aferição de uma pipeta volumétrica (figura 1) é feita por meio da pesagem da água que dela é escoada e o tempo de escoamento necessita ser considerado.
( ) Antes do uso da bureta (figura 3), é necessário ambientá-las com a própria solução que irá analisar, a fim de evitar o risco de contaminação com vestígios de outras soluções que ainda possam estar impregnadas nas paredes internas.
Assinale a alternativa que apresenta a sequência correta, quando lida de cima para baixo.
A legislação ambiental de certos estados brasileiros não permite o lançamento em ambientes aquáticos de efluentes com pH inferior a 5,0 ou superior a 9,0. No que se refere à acidez, os efluentes líquidos das Indústrias A, B e C apresentam as seguintes concentrações:
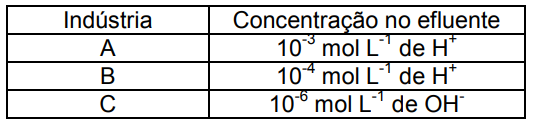
Considerando o quadro acima, poderiam ser lançados em ambientes aquáticos, sem tratamento, apenas os efluentes da(s) Indústria(s):