Questões de Concurso
Foram encontradas 8.712 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Dada a reação não balanceada a seguir:
r Fe2+ + s Cr2O72− + t H+ → u Fe3+ + v Cr3+ + w H2O
Completa r, s, t, u, v e w, correta e respectivamente, os coeficientes
As baterias primárias de lítio são alternativas de fornecimento de energia elétrica de longa duração podendo durar até oito anos. Por isso são utilizados em marca-passo cardíaco. A reação global que ocorre nesse tipo de bateria está representada a seguir.
Dados os potenciais de redução:
Li+ (aq) + e− → Li(s); E° = −3,05 V
I2 (s) + 2e− → 2 I− (aq); E° = + 0,54 V
2 Li(s) + 1 I2(s) → 2 LiI(s)
Com relação a esta pilha afirma-se:
I. O potencial da pilha é de 3,59 V.
II. O cátodo é o lítio metálico.
III. No ânodo ocorre a oxidação do iodo.
IV. O oxidante é o iodo I2.
Está correto o que se afirma APENAS em
Pilhas alcalinas geram corrente elétrica por um período de tempo até 50% mais longo do que uma pilha seca do mesmo tamanho. Considere a reação abaixo, que ocorre nas pilhas alcalinas, e indique a alternativa que apresenta corretamente a reação que ocorre no catodo e no anodo.
Zn(s) + 2 MnO2
(s) → ZnO(s) + Mn2
O3
(s)
Uma reação do tipo 2A(g) + Z(g) →2T(g) foi monitorada variando-se a concentração dos reagentes. A velocidade de formação de T foi medida conforme a tabela abaixo.
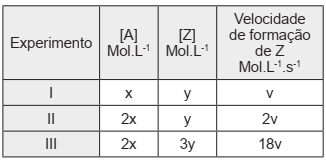
Determine a lei de velocidade e calcule a velocidade da reação em função de v se [A] for x e [Z]
for 3y.
Em um laboratório, preparou-se uma solução básica de NaOH, pesando-se uma determinada massa do reagente. Visto que o NaOH tem propriedade higroscópica, esta solução foi padronizada com um padrão primário, biftalato ácido de potássio. Para este procedimento, utilizou-se 25mL da solução de NaOH preparada e titulou-se com biftalato ácido de potássio. A massa de biftalato de potássio utilizada para padronização foi de 0,4000g. A reação entre titulante e titulado, pode ser representada pela equação:
KHC8H4O4(s) + NaOH(aq) → KNaC8H4O4(aq) + H2O(l)
Uma amostra contendo 514 mg de C8 H18, um dos componentes da gasolina, foi colocada em um calorímetro com oxigênio suficiente para promover a combustão completa. O calorímetro foi preenchido com 1,8 L de água e a capacidade calorífica do interior do calorímetro (sem água) é 1,06 kJ.°C-1. A reação promove uma variação de temperatura de 2,8 °C.
Dados: Capacidade calorífica molar da água = 75,3 J.°C-1.mol-1.
Massas atômicas: C=12; H=1
Qual é o calor de combustão por mol, aproximado, de C8 H18?
O Cloreto de alumínio sólido é um ácido de Lewis muito utilizado nas reações de substituição orgânica.
O valor da entalpia padrão de formação deste ácido de Lewis encontra-se entre:
Dados:
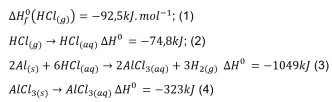
(Fonte: ATKINS, Peter; JONES, Loretta; LAVERMAN,
Leroy. Princípios de Química: Questionando a Vida
Moderna e o Meio Ambiente. Bookman Editora, 2018)
“O boro forma uma série notável de compostos binários com o hidrogênio – os boranos. Esses compostos incluem o diborano, B2 H6 , e compostos mais complexos, como o decaborano, B10H14”
(JONES, L.; ATKINS, P. Princípios de química: questionando a vida moderna e o meio ambiente. 5. ed. Porto Alegre: Bookman. 2011.p.632)
Moléculas como o diborano são deficientes em elétrons e, por isso, não podemos escrever estruturas de Lewis válidas. Duas ligações B-H-B são formadas na molécula, formando pontes de hidrogênio. Esse padrão de ligação também é visto no hidrogênio protonado (H3 + ), por exemplo. Como são conhecidas ligações como as pontes presentes no diborano?
A forma como alguns temas são abordados no ensino de química, leva o estudante a imaginar química como uma ciência abstrata, dificultando o processo de ensino e aprendizagem. Para o ensino do conteúdo de modelos moleculares pode-se fazer uso de métodos alternativos didáticos que promovam a melhor visualização das ligações químicas entre átomos e a consequente formação de moléculas e seu arranjo espacial.
A tabela abaixo mostra a relação dos diferentes tipos de átomos com respectivos ângulos de ligação e formato destes no modelo:
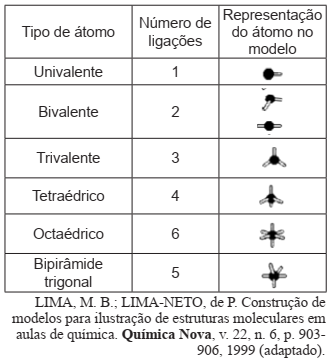
Com base nessas informações e em seus conhecimentos sobre geometria molecular, pode-se afirmar que, a geometria molecular:
Pesquisadores japoneses identificaram uma enzima, chamada de PETase, capaz de promover a transformação do polímero poli-tereftalato de etileno em 1,2-etanodiol e ácido tereftálico.
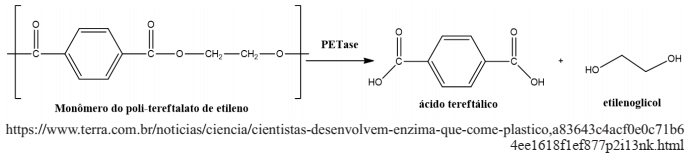
Considere que uma amostra de 1 tonelada de garrafas PET contenha o polímero na forma pura. Após a ação
da enzima, qual o volume de etilenoglicol, em L, produzido, sabendo que a densidade desse diol é 1,11
g.cm-3 e que as massas atômicas são: C = 12, H = 1 e O = 16?
O gráfico apresentado a seguir relaciona os pontos de ebulição dos compostos formados por elementos da família 5A e hidrogênio em função do número atômico do elemento.

As propriedades que explicam os fatos de o ponto
de ebulição da amônia ser maior que o da fosfina e
menor que o do hidreto de bismuto (III) são:
Cristais macroscópicos idiomórficos podem ser produzidos pela evaporação de água à temperatura ambiente de soluções aquosas supersaturadas. As solubilidades, a 20ºC, de alguns sais e sua respectiva toxicidade podem ser vistas na tabela abaixo:
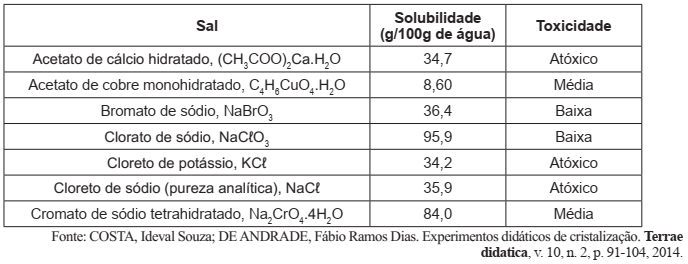
De acordo com os dados acima é correto afirmar que:
São apresentados na tabela abaixo os valores de entalpia de vaporização e os pontos de ebulição de algumas substâncias:
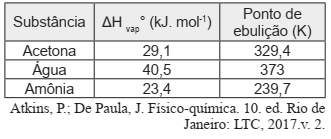
A entropia de vaporização, ΔS vap, da acetona, água e
amônia em J.K-1.mol -1, são, respectivamente:
Considere os potenciais padrões de redução apresentados abaixo:
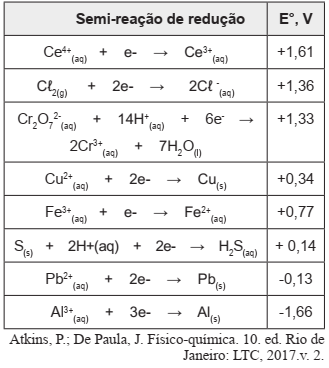
Identifique nas reações abaixo, a que é classificada
como um processo espontâneo.