Questões de Concurso
Foram encontradas 8.712 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Uma das etapas da síntese da droga Sofosbuvirr consiste na proteção da hidroxila do material de partida, a lactona, com brometo de benzila (BnBr), segundo o esquema abaixo:
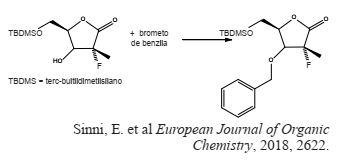
De acordo com as informações a reação pode ser
classificada como:
Para determinar o teor de prata em uma liga, realizou-se um procedimento de gravimetria. Tal procedimento partiu de uma amostra da liga de 5g à qual foi submetida a abertura com ácido nítrico seguido de tratamento com solução de cloreto de sódio. Ao fim do procedimento foram obtidos 4,3g de precipitado. A partir dessas informações pode-se constatar que o teor de prata na liga analisada era, aproximadamente, de:
Considere as seguintes massas molares em g. mol-1: Na = 23, Cℓ = 35, Ag = 108).
Em um experimento de laboratório, uma aluna foi solicitada a ordenar 3 elementos (A, B, C) de acordo com seus potenciais de redução. Para isso, realizou o seguinte procedimento: adicionou um pedaço de metal (A, B, C) em soluções aquosas contendo os cátions dos outros metais (A+, B2+, C2+) e também em solução ácida e observou onde ocorreu reação. Ao fim do experimento, elaborou uma tabela onde indicou com X os sistemas onde ocorreram reação com deposição de metal ou desprendimento de H2 , tendo obtido a seguinte tabela:
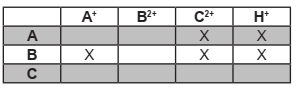
Ao organizar as espécies iônicas por ordem crescente de potencial de redução, com base no procedimento adotado e nos resultados tabelados, têm-se:
Considerando a reação de formação do trióxido de enxofre no equilíbrio e sob temperatura e pressão constantes, é correto afirmar que:
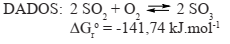
Corrosão eletroquímica de um metal é um processo que envolve reações redox espontâneas, como exemplo, a indesejada ferrugem. Esta é originada do processo corrosivo do ferro. Um procedimento para evitar a corrosão é a adição de um metal de sacrifício para ser ______________ preferencialmente por apresentar um ___________ potencial de ____________.
Assinale a alternativa que completa o texto acima corretamente.
No laboratório de biologia, dentre os fixadores mais utilizados na preservação de animais para uso didático, encontram-se o formol e o etanol nas respectivas concentrações: 10% e 70%. Um professor solicitou ao técnico de laboratório que preparasse meio litro de formol a 10% e um litro de álcool a 70%.
Os reagentes disponíveis para o preparo dessas soluções eram: um litro de formol a 37% e um litro de etanol a 98%. Quais foram as quantidades utilizadas pelo técnico para preparar as soluções de formol e álcool, respectivamente?
A equação química não balanceada, apresentada a seguir, demonstra a reação do permanganato de potássio com peróxido de hidrogênio em meio ácido.
mKMnO4 + nH2SO4 + oH2O2 → pK2SO4 + qH2O + rO2 + sMnSO4
Considerando o balanceamento adequado da equação, a somatória dos coeficientes estequiométricos dos reagentes é igual a
Uma pilha foi montada com eletrodos de Al e Fe. Considerando as semirreações e os potenciais de redução apresentados a seguir, o valor do potencial da pilha mencionada, em Volts (V), é igual a
Dados:
Al3+ + 3e- ⇌ Al E0 = -1,66 V
Fe2+ + 2e- ⇌ Fe E0 = -0,44 V
75 mL de uma solução de HCl 0,100 mol L-1 foram misturados com 25 mL de uma solução de NaOH 0,100 mol L-1 . Considerando essas informações, o pH da solução final foi igual a:
Dado: log 5 = 0,70
Uma massa de 0,10 g de ácido benzoico (112 g mol-1) foi dissolvida em solvente apropriado e transferida quantitativamente para um erlenmeyer e adicionaram-se gotas de fenolftaleína. Posteriormente, adicionou-se uma solução de NaOH (40 g mol-1) de concentração desconhecida que consumiu um volume de 8,0 mL. A reação química que ocorre entre o ácido e a base está apresentada na figura que segue.
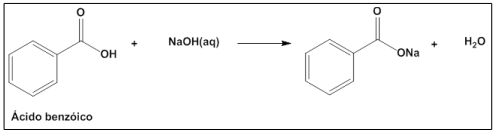
A concentração, em mol L-1, da solução de hidróxido de sódio é, aproximadamente:
Com base no conhecimento da estrutura química das moléculas orgânicas, essas podem ser manipuladas a partir de condições reacionais específicas e transformadas em outros compostos, conforme sugere a figura a seguir.
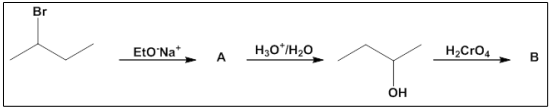
Considerando os produtos principais das reações, os compostos orgânicos A e B são, respectivamente: