Questões de Concurso
Foram encontradas 8.725 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Considere
Ka do CH3COOH igual a 1,75x10-5 e
Kb do NH4OH igual a 1,78x10-5

Considere
Ka do CH3COOH igual a 1,75x10-5 e
Kb do NH4OH igual a 1,78x10-5

Um cromatograma de uma mistura de compostos apresenta 6 picos. Em relação a esse fato, afirma-se:
I. A mistura contém apenas 6 substâncias diferentes.
II. Dos componentes da mistura, a técnica conseguiu detectar apenas 6 substâncias diferentes.
III. A adição, à amostra original, de um padrão de uma das substâncias detectadas na mistura provoca um deslocamento de seu pico correspondente no cromatograma.
IV. A adição, à amostra original, de um padrão de uma das substâncias detectadas na mistura provoca um aumento na intensidade de seu pico correspondente.
Dentre as afirmativas, estão corretas
Considere
Ka do CH3COOH igual a 1,75x10-5 e
Kb do NH4OH igual a 1,78x10-5

Considere
Ka do CH3COOH igual a 1,75x10-5 e
Kb do NH4OH igual a 1,78x10-5

Considere
Ka do CH3COOH igual a 1,75x10-5 e
Kb do NH4OH igual a 1,78x10-5

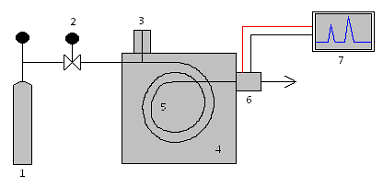
A figura representa um sistema destinado à análise por cromatografia
Considere
Ka do CH3COOH igual a 1,75x10-5 e
Kb do NH4OH igual a 1,78x10-5

Considere
Ka do CH3COOH igual a 1,75x10-5 e
Kb do NH4OH igual a 1,78x10-5

Considere
Ka do CH3COOH igual a 1,75x10-5 e
Kb do NH4OH igual a 1,78x10-5

Considere
Ka do CH3COOH igual a 1,75x10-5 e
Kb do NH4OH igual a 1,78x10-5

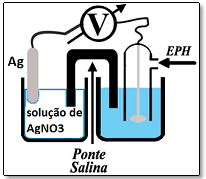
A figura exibida ao lado representa uma célula potenciométrica.
A concentração, em mol L-1 ,de íons Ag+ na solução, quando o potencial medido for igual ao potencial padrão de redução da reação estabelecida no eletrodo indicador, será
Considere
Ka do CH3COOH igual a 1,75x10-5 e
Kb do NH4OH igual a 1,78x10-5

Considere
Ka do CH3COOH igual a 1,75x10-5 e
Kb do NH4OH igual a 1,78x10-5

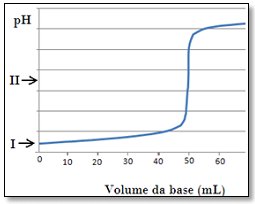
A figura apresentada ao lado representa a titulação para 100 mL de uma solução de HCl com uma solução padrão de NaOH 0,2 mol L-1 .
Os valores de pH indicados pelas setas no gráfico são, respectivamente:
Considere
Ka do CH3COOH igual a 1,75x10-5 e
Kb do NH4OH igual a 1,78x10-5

Considere
Ka do CH3COOH igual a 1,75x10-5 e
Kb do NH4OH igual a 1,78x10-5

O pH ideal do plasma sanguíneo é aproximadamente 7,4. Quando, nesse meio, o pH fica menor que 6,8 ocorre acidose e quando ultrapassa 7,8 ocorre alcalose. São vários os processos que contribuem para a manutenção do pH plasmático e um dos mais importantes diz respeito ao equilíbrio mostrado a seguir:
HCO- 3 + H+ ⇆ H2CO3 ⇆ H2O + CO2
Considere
Ka do CH3COOH igual a 1,75x10-5 e
Kb do NH4OH igual a 1,78x10-5

As afirmativas a seguir referem-se a reações de neutralização.
I. Sais derivados de ácidos fortes com bases fortes se dissolvem na água para produzir íons H3O+ ou íons OH- .
II. A reação estequiométrica entre um ácido forte e uma base fraca produz uma solução ácida.
III. A reação estequiométrica entre um ácido fraco e uma base forte produz uma solução ácida.
IV. Sais derivados de ácidos ou bases fracas se dissolvem na água para produzir íons H3O+ ou íons OH- .
Dentre as afirmativas, estão corretas apenas
Considere
Ka do CH3COOH igual a 1,75x10-5 e
Kb do NH4OH igual a 1,78x10-5

Considere as seguintes soluções.
I. Uma solução 0,1 mol L-1 de NaCl.
II. Uma solução 0,1 mol L-1 de CH3COONa.
III. Uma solução 0,1 mol L-1 de NH4Cl.
IV. Uma solução mista de CH3COOH e CH3COONa com concentrações iguais a 0,1 mol L -1 de ambas as substâncias.
Com relação ao parâmetro acidez, podemos afirmar que as soluções são, respectivamente:
Considere
Ka do CH3COOH igual a 1,75x10-5 e
Kb do NH4OH igual a 1,78x10-5

Considere
Ka do CH3COOH igual a 1,75x10-5 e
Kb do NH4OH igual a 1,78x10-5

Para escoar o volume de uma pipeta do tipo volumétrica, conforme a apresentada na figura, deve-se

Considere
Ka do CH3COOH igual a 1,75x10-5 e
Kb do NH4OH igual a 1,78x10-5

A análise volumétrica de uma determinada amostra de um ácido diprótico, com NaOH 0,100 mol L-1 , foi realizada usando-se o seguinte procedimento: inicialmente, coletou-se uma alíquota da amostra com o instrumento (1) indicado na figura ao lado; após a devida aferição de volume, a alíquota foi transferida para o instrumento (2); em seguida, o volume do instrumento (2) foi aferido com água destilada; posteriormente, uma alíquota da solução obtida foi coletada com o instrumento (3), devidamente aferido, e transferida para o instrumento (4), onde adicionou-se um indicador apropriado; ao acionar o instrumento (5), observou-se a mudança da cor da solução titulada após a adição do volume indicado pela seta.
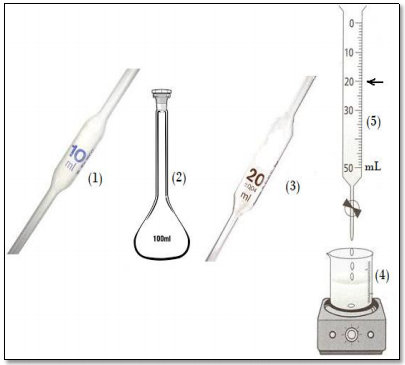
Para a reação envolvida na titulação, devidamente balanceada, o resultado da soma dos coeficientes estequiométricos é