Questões de Concurso
Foram encontradas 1.343 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
A imagem abaixo mostra o caminho percorrido pela água desde a captação até a chegada às residências.

O cimento depende, principalmente, para sua fabricação, do emprego de materiais, como calcário, argila, minério de ferro e gesso. Durante a fabricação, são feitas diversas análises nos materiais a fim de alcançar a composição química desejada. Para atingir tal objetivo, a fabricação do cimento envolve uma série de operações.
Sobre os processos de moagem na fabricação do cimento, assinale a alternativa INCORRETA.
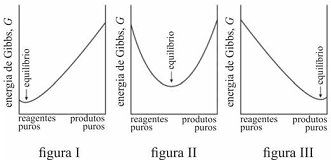
É possível prever, termodinamicamente, se os reagentes de uma mistura têm a tendência espontânea para se transformarem em produtos, se a composição, no equilíbrio, será modificada ao se alterarem as condições de um sistema, entre outros comportamentos termodinâmicos. Acerca de equilíbrio químico e considerando os gráficos representados nas figuras I, II e III, que mostram três situações de equilíbrio, julgue o item que se segue.
Na reação representada pelo gráfico da figura I, quantidades muito pequenas dos reagentes se convertem em produtos antes que G alcance seu valor mínimo e a reação se processe lentamente.
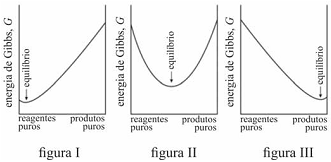
É possível prever, termodinamicamente, se os reagentes de uma mistura têm a tendência espontânea para se transformarem em produtos, se a composição, no equilíbrio, será modificada ao se alterarem as condições de um sistema, entre outros comportamentos termodinâmicos. Acerca de equilíbrio químico e considerando os gráficos representados nas figuras I, II e III, que mostram três situações de equilíbrio, julgue o item que se segue.
O critério termodinâmico para uma transformação espontânea, à temperatura e à pressão constantes, é que a variação da energia de Gibbs seja maior que zero.
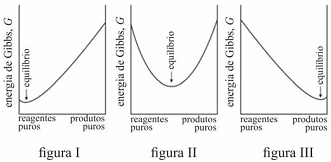
É possível prever, termodinamicamente, se os reagentes de uma mistura têm a tendência espontânea para se transformarem em produtos, se a composição, no equilíbrio, será modificada ao se alterarem as condições de um sistema, entre outros comportamentos termodinâmicos. Acerca de equilíbrio químico e considerando os gráficos representados nas figuras I, II e III, que mostram três situações de equilíbrio, julgue o item que se segue.
Em uma reação química, a variação da energia de Gibbs de
reação com a temperatura depende da entropia de reação. A
energia de Gibbs de uma reação que produz gás aumenta com
o aumento da temperatura.
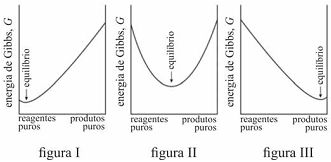
Caso G varie como apresentado no gráfico da figura III, uma
proporção alta de produtos tende a se formar antes de G
alcançar seu mínimo.
Com relação à energia interna e à primeira lei da termodinâmica, julgue o item a seguir.
Considere que um gás ideal, ocupando um volume de 2,0 L,
tenha sofrido uma transformação isobárica, a uma pressão de
1,5 atm, e tenha passado a ocupar um volume de 4,5 L,
absorvendo, nesse processo, 1.000 J de calor. Nessa situação,
a variação da energia interna do sistema é superior a 615 J.
Com relação à energia interna e à primeira lei da termodinâmica, julgue o item a seguir.
A única forma de mudar a energia interna de um sistema fechado é transferir energia para ele na forma de calor ou trabalho.
Com relação à energia interna e à primeira lei da termodinâmica, julgue o item a seguir.
Se, em um sistema adiabático, ocorre um processo reversível,
a variação da entropia é maior que zero.
Com relação à energia interna e à primeira lei da termodinâmica, julgue o item a seguir.
Um processo é considerado espontâneo quando ocorre sem a
influência externa. A entropia de um sistema isolado aumenta
durante qualquer mudança espontânea.
O processo de Haber-Bosh, que opera em altas temperaturas e altas pressões, é bastante utilizado para a produção industrial da amônia (NH3). Nesse processo, os gases nitrogênio (N2) e hidrogênio (H2) reagem exotérmica e reversivelmente para formar amônia gasosa (NH3). No processo inverso, a reação de decomposição da amônia em nitrogênio e hidrogênio em superfície de platina apresenta cinética que segue comportamento conforme representado no gráfico acima, que mostra a variação da concentração molar da amônia gasosa [NH3] em função do tempo. Acerca dessas reações, julgue o item a seguir.
Se a taxa de formação da amônia for de 3,2 × 10-2 mol.L-1 .s- 1 , então as taxas de consumo dos gases N2 e H2, serão, respectivamente, 1,6 × 10-2 mol.L-1 .s-1 e 4,8 × 10-2 mol . L- 1.s -1 .
O processo de Haber-Bosh, que opera em altas temperaturas e altas pressões, é bastante utilizado para a produção industrial da amônia (NH3). Nesse processo, os gases nitrogênio (N2) e hidrogênio (H2) reagem exotérmica e reversivelmente para formar amônia gasosa (NH3). No processo inverso, a reação de decomposição da amônia em nitrogênio e hidrogênio em superfície de platina apresenta cinética que segue comportamento conforme representado no gráfico acima, que mostra a variação da concentração molar da amônia gasosa [NH3] em função do tempo. Acerca dessas reações, julgue o item a seguir.
A partir do gráfico, é correto concluir que a reação envolvida
é de ordem zero e que o módulo do valor da inclinação da reta
representa a constante de velocidade da reação de consumo
da amônia.
No ciclo de Carnot, ilustrado acima, no gráfico de pressão (P) versus volume (V), ocorrem processos reversíveis que passam pelos estados A, B, C e D. Considerando que as curvas do gráfico apresentam o comportamento de um gás ideal em um sistema fechado, que os processos BC e DA são adiabáticos e que AB e CD são isotérmicos, ocorrendo nas temperaturas T2 e T1, respectivamente, julgue o item subsequente.
Nas condições especificadas, se T1 for menor do que T2, o
rendimento desse ciclo será de 100%.
No ciclo de Carnot, ilustrado acima, no gráfico de pressão (P) versus volume (V), ocorrem processos reversíveis que passam pelos estados A, B, C e D. Considerando que as curvas do gráfico apresentam o comportamento de um gás ideal em um sistema fechado, que os processos BC e DA são adiabáticos e que AB e CD são isotérmicos, ocorrendo nas temperaturas T2 e T1, respectivamente, julgue o item subsequente.
O trabalho e o calor não são funções de estado, diferentemente
da energia interna, que depende somente do estado em que se
encontra o sistema.
No ciclo de Carnot, ilustrado acima, no gráfico de pressão (P) versus volume (V), ocorrem processos reversíveis que passam pelos estados A, B, C e D. Considerando que as curvas do gráfico apresentam o comportamento de um gás ideal em um sistema fechado, que os processos BC e DA são adiabáticos e que AB e CD são isotérmicos, ocorrendo nas temperaturas T2 e T1, respectivamente, julgue o item subsequente.
A variação da entropia para o sistema e suas vizinhanças, após
o gás percorrer o ciclo acima e retornar ao estado inicial A, é
nula.

