Questões de Concurso
Foram encontradas 3.145 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
A entalpia de uma reação é a soma das entalpias de qualquer sequência de reações (na mesma temperatura e pressão) na qual a reação total pode ser dividida. Assim, a variação de entalpia para qualquer processo depende somente da natureza dos reagentes e dos produtos e independe do número de etapas do processo ou da maneira como é realizada a reação.
A formação da chuva está relacionada às mudanças de estado físico da água.
Considere as seguintes afirmativas referentes às mudanças de estado físico da água.
I – Condensação é a mudança da substância, do estado gasoso para o estado líquido.
II – Evaporação é a mudança da substância, do estado líquido para o estado gasoso.
III - Fusão é a mudança da substância, do estado sólido para o estado gasoso.
IV – Solidificação é a mudança da substância, do estado sólido para o estado líquido.
São verdadeiras, apenas, as seguintes afirmativas:
 A figura acima mostra a tabela periódica proposta por
Mendeleev, em 1869. Ao longo de cento e cinquenta anos,
a tabela foi sofrendo modificações, como o acréscimo de
novos componentes e o agrupamento dos elementos de
acordo com características comuns. Atualmente os
elementos estão classificados em metais, ametais (não
metais), gases nobres e hidrogênio.
Assinale a seguir um exemplo de ametal:
A figura acima mostra a tabela periódica proposta por
Mendeleev, em 1869. Ao longo de cento e cinquenta anos,
a tabela foi sofrendo modificações, como o acréscimo de
novos componentes e o agrupamento dos elementos de
acordo com características comuns. Atualmente os
elementos estão classificados em metais, ametais (não
metais), gases nobres e hidrogênio.
Assinale a seguir um exemplo de ametal: 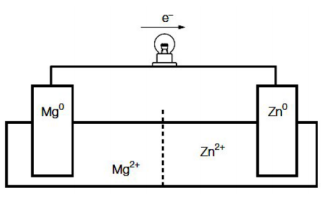
Sabendo-se que os elétrons fluem do eletrodo de magnésio para o eletrodo de zinco, é correto afirmar que
A concentração é uma característica importante para análise e interpretações de propriedades para as soluções e um dado necessário para seu uso no laboratório, na indústria e no cotidiano.
Abaixo, estão desenhados recipientes com os respectivos volumes de solução e massas de hidróxido de sódio (NaOH = 40g/mol).
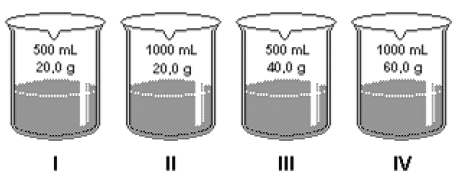
I. A solução contida no frasco I apresenta concentração de 1,0 mol/L;
II. As 4 soluções apresentarão pH acima de 7;
II. A solução mais concentrada está presente no frasco III.
São corretas as afirmações:

[H2]=1,83x10-3 mol/L, [l2]= 3, 12x10-3 mol/L e [HI]= 17,67 X 10-3 mol/L. 2 HI(g)
 H2(g) + I2(g)
H2(g) + I2(g)Considere as seguintes reações para células eletroquímicas e assinale a alternativa correta.
1. Cu2+ + Zn0  Cu0 + Zn2+ E= 1,1V
Cu0 + Zn2+ E= 1,1V
2. Cu0 + Zn 2+ 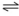 Cu2+ + Zn0 E= -1,1V
Cu2+ + Zn0 E= -1,1V
Referente à seguinte reação:
Mg (s) + O2 (g) MgO(s) ------------>
analise as assertivas e assinale a alternativa que aponta as corretas.
I. É uma reação de combinação.
II. A molécula de oxigênio é formada por ligação iônica.
III. A queima de 2 mol de Mg(s) resulta em 1 mol de MgO.
IV. O produto da reação é um sólido iônico.
1. Forças de London. 2. Ligação de hidrogênio. 3. Dipolo-dipolo.
( ) H2S ( ) NH3 ( ) I2
No estudo de Termoquímica, o professor propôs uma experiência para determinação do calor de combustão do álcool etílico (etanol).
O procedimento experimental e as anotações de um grupo de alunos estão apresentados a seguir:
I. preparar a lamparina colocando uma quantidade suficiente de álcool etílico para que a combustão possa ser realizada.
II. determinar a massa do sistema “álcool-lamparina” (mi) e anotar no caderno. Valor anotado mi= 180,0 g;
III. determinar a massa do erlenmeyer (me) vazio e anotar no caderno. Valor anotado me = 200,0 g;
IV. medir 100 mL de água, que correspondem a 100 g, em uma proveta e transferir para o erlenmeyer. Envolver as paredes do erlenmeyer com jornal e prender com fita crepe. Colocar em um suporte;
V. medir a temperatura da água (Ti) e anotar o valor. Valor anotado Ti = 25°C; VI. acender a lamparina e aquecer a água do erlenmeyer, durante 5 minutos. Após esse tempo, apagar a lamparina e medir a temperatura da água (Tf) e anotar o valor. Valor anotado Tf = 40°C;
VII. Medir, após algum tempo, a massa do sistema “álcool-lamparina”(mf) após a combustão. Valor anotado mf = 160,0 g.
Utilizando os dados anotados e a constante 1,0 cal.g–1 .°C –1 como calor específico da água e a constante 0,2 cal.g–1 .°C –1 como calor específico do vidro, os alunos devem chegar a um valor para o calor de combustão do álcool, em cal.g–1 , de