Questões de Concurso
Foram encontradas 3.145 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Texto 19A1AAA
O titânio, um metal de transição do “bloco d” da tabela periódica, é bastante empregado em ligas metálicas devido a sua elevada resistência mecânica e baixa tendência à corrosão, além da baixa densidade. Ele é obtido a partir, principalmente, da ilmenita (FeTiO3) e do rutilo (TiO2).
Texto 19A1AAA
O titânio, um metal de transição do “bloco d” da tabela periódica, é bastante empregado em ligas metálicas devido a sua elevada resistência mecânica e baixa tendência à corrosão, além da baixa densidade. Ele é obtido a partir, principalmente, da ilmenita (FeTiO3) e do rutilo (TiO2).
Para preparar 500 mL de uma solução de ácido clorídrico, HCl, 6,0 mol/L, um funcionário de um laboratório químico empregou uma solução de ácido clorídrico de concentração 12 mol/L.
O volume do ácido clorídrico 12 mol/L empregado para a preparação da solução 6,0 mol/L foi
Um funcionário de laboratório de análises precisa preparar 1 L de uma solução de hidróxido de sódio, NaOH, massa molar 40 g/mol, com concentração 0,5 mol/L.
Assinale a alternativa que apresenta a massa de hidróxido de sódio que deve ser empregada para o reparo dessa solução.
O indicador ácido-base azul de bromotimol apresenta as seguintes características em solução aquosa:
pH 1 cor amarela
pH 7 cor verde
pH 12 cor azul
Em um laboratório químico foram adicionadas gotas do indicador azul de bromotimol em cada um dos três tubos de ensaio identificados na figura.
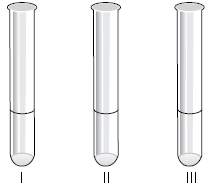
I. Soro fisiológico (solução aquosa de sal de cozinha e açúcar).
II. Solução aquosa de hidróxido de sódio.
III. Solução aquosa de ácido clorídrico.
É correto afirmar que as soluções dos tubos I, II e III apresentaram, respectivamente, as colorações:
O sulfato de alumínio pode ser obtido a partir da reação representada na equação não balanceada:
Al2 O3 (s) + H2 SO4 (aq) → Al2 (SO4 )3(aq) + H2 O(l)
Quando o balanceamento da equação é feito usando-se o coeficiente 1 para Al2 O3 , os coeficientes para o H2 SO4 e para H2 O são, correta e respectivamente,
A figura a seguir representa um procedimento empregado para separação de uma mistura ____________ entre ____________.

(explicatorium.com. Adaptado)
Assinale a alternativa que preenche, correta e respectivamente, as lacunas da frase.
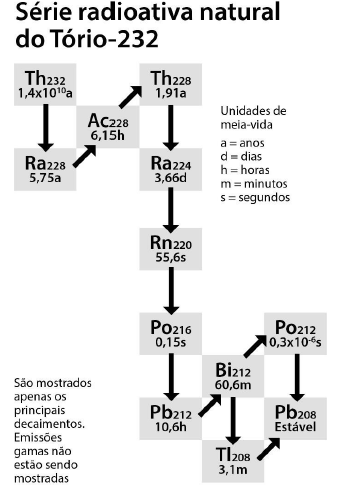
Considerando as informações da figura, pode-se afirmar corretamente que:
As características químicas da água ocorrem em função da presença de substâncias dissolvidas, geralmente mensuráveis apenas por meios analíticos.
Relacione a COLUNA II com a COLUNA I associando os indicadores químicos das águas às suas propriedades.
COLUNA I
1. Dureza
2. Alcalinidade
3. Corrosividade
4. Salinidade
COLUNA II
( ) Indicador caracterizado pela presença de ácidos minerais ou soluções de oxigênio que atuam sobre os metais.
( ) Característica conferida à água pela presença de sais de metais alcalino-terrosos e alguns outros metais em menor quantidade.
( ) Presença na água de substâncias como bicarbonatos, cloretos e sulfatos, conferindo a ela um sabor característico.
( ) Característica decorrente da presença de bicarbonatos, carbonatos e hidróxidos, quase sempre de metais alcalinos ou alcalino-terrosos.
Assinale a sequência correta.
Considere que um estudante misturou 20 mL de uma solução aquosa de HCl 1,0 mol/L com 20 mL de uma solução aquosa de NaOH 1,0 mol/L em um calorímetro. A temperatura da mistura reacional aumentou de 20 ºC para 28 ºC.
Partindo do princípio que a perda de calor da mistura reacional para o ambiente é desprezível e que o volume total da mistura é 40 mL, é correto afirmar que a variação da entalpia da reação é mais próxima de
Dados:
Calor específico (c) do meio reacional é igual a 4,18 J/g K.
Densidade (d) da mistura é igual a 1,0 g/mL.
A lei de absorção, também conhecida como Lei de Beer, diz quantitativamente como a grandeza da atenuação depende da concentração das moléculas absorventes e da extensão do caminho sobre o qual ocorre a absorção. A transmitância T da solução é a fração da radiação incidente transmitida pela solução.
Considerando que um feixe de radiação, ao passar por uma solução absorvente, registrou uma absorbância X, é correto afirmar que a transmitância será igual a
Considere que em uma amostra de água fluvial foi analisada a concentração de Fe+2 por meio da titulação redox. Para isso retirou-se uma alíquota de 50 mL da amostra da água, que foi titulada com uma solução-padrão de KMnO4 0,10 mol/L em meio ácido.
Se 20 mL da solução de permanganato são necessários para atingir o ponto final da titulação, a concentração de íon ferro (II), em mol/L, na água fluvial, é igual a
Na área de estudo da potenciometria, sabe-se que o eletrodo indicador é um dispositivo que, imerso na solução contendo o analito, desenvolve um potencial, que depende da atividade do analito. A maioria dos eletrodos indicadores empregados na potenciometria é seletiva em sua resposta.
Um eletrodo que é classificado como eletrodo indicador é o
Analise a situação a seguir.
Em um preparo de 100 mL de uma solução de ácido clorídrico (HCl) 0,1 mol/L, um técnico retirou da solução estoque 1 mL e completou com água até a linha de aferição.
Considerando que a densidade da solução estoque era 1,1 g/mL, qual a porcentagem aproximada em massa do ácido que estava contida no estoque?
Uma série natural de decaimento radioativo começa com uma espécie radioativa que, ao emitir radiações alfa, beta e / ou gama, forma uma espécie mais estável.
Considere que um mol de um elemento radiativo emitiu sete mols de partículas alfa e quatro mols de partículas beta produzindo um mol de um elemento mais estável.
Nesse contexto, qual processo reacional nuclear pode representar esse decaimento radioativo?
A formação de complexos é usada de muitas maneiras em Química Analítica . A análise química nessa área pode ser utilizada, por exemplo, para medir a quantidade de um analito, para controlar a quantidade efetiva deste que está disponível para outras reações ou como ferramenta para separação de substâncias químicas.
Considerando esse contexto, avalie as seguintes afirmativas e a relação proposta entre elas.
I. A formação de complexos é uma reação na qual ocorre uma ligação reversível entre duas ou mais espécies químicas distintas, como por exemplo, a amônia e Cu2+,
POR QUE
II. nesse caso o NH3 fornece um par de elétrons para os orbitais externos de um íon Cu2+, formando um complexo entre a amônia e o íon metálico, característico de uma reação ácido-base de Lewis.
A respeito dessas afirmativas e da relação proposta entre elas, assinale a alternativa correta.
Em análises químicas, os erros sistemáticos têm um valor definido e uma causa justificável, sendo da mesma ordem de grandeza para réplicas de medidas realizadas de maneira semelhante. Existem três tipos de erros sistemáticos: instrumentais, no método e do operador.
Entre os exemplos a seguir, aquele que é considerado um erro instrumental é:
As propriedades das substâncias aumentam sua magnitude de acordo com os tipos de interações entre moléculas predominantes.
Nesse sentido, é correto afirmar que as forças intermoleculares são fortes quando se têm menores
Os métodos potenciométricos de análises se baseiam na medida do potencial de células eletroquímicas, sem o consumo apreciável de corrente. Há cerca de um século, as técnicas potenciométricas têm sido utilizadas para localizar o ponto final em titulações.
Considere que em uma titulação potenciométrica de 10 mL de ácido clorídrico (HCl), a partir de um padrão de NaOH 0,10 mol/L, os resultados experimentais foram estimados utilizando o método da primeira derivada, conforme descrito no gráfico a seguir.
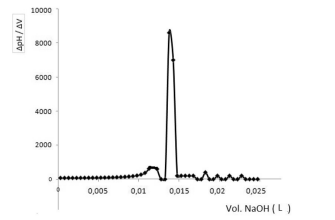
Nesse contexto, a concentração de ácido clorídrico em
mol/L titulado por hidróxido de sódio é igual a
