Questões de Concurso
Foram encontradas 3.145 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Considerada como técnica analítica bem-sucedida, a espectrometria de absorção atômica é uma das mais utilizadas na determinação de elementos em baixas concentrações, que estão presentes em uma variedade de amostras, líquidas, sólidas, em suspensão ou até mesmo gasosas.
Sobre a técnica de espectrometria de absorção atômica, assinale com V as afirmativas verdadeiras e com F as falsas.
( ) A técnica de absorção atômica pode ser aplicada para quantificar vários elementos ao mesmo tempo.
( ) Instrumentos de absorção atômica utilizam um plasma de alta temperatura para atomização e excitação da amostra.
( ) A determinação de espécies atômicas somente é feita em meio gasoso, no qual os átomos individuais ou íons elementares se encontram bem espaçados uns dos outros.
( ) As análises quantitativas pela técnica de absorção atômica são baseadas em calibração com padrões externos e não devem ser fundamentadas na medida de um único padrão, presumindo que a Lei de Beer esteja sendo obedecida.
Assinale a sequência correta.
A Aspirina, como é conhecida o ácido acetilsalicílico (C9H8O4), é um fármaco que apresenta propriedades antitérmicas, anti-inflamatórias e analgésicas. Esse fármaco pode ser sintetizado pela reação entre o ácido salicílico (C7H6O3) e o anidrido acético (C4H6O3), catalisada por um ácido.
A equação a seguir representa o processo de síntese da aspirina.
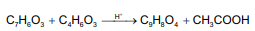
Considere, hipoteticamente, que 3 g de ácido salicílico foram misturados com 6 mL de uma solução de anidrido acético cuja densidade e grau de pureza são 1,2 g/mL e 80% m/m, respectivamente.
Se o rendimento da reação química é 100%, qual a
massa aproximada de aspirina produzida em gramas?
O eteno, buteno, propileno, poliestireno e poliacetato de vinila são exemplos de polímeros sintéticos.
A destilação fracionada é um método utilizado para separar líquidos miscíveis e cujas temperaturas de ebulição são iguais.
Dado: MM CuCl = 99 g.mol-1
A reação mostrada abaixo é classificada como:
CaC03 → CaO + C02
Considerando a reação química mostrada abaixo:

A fórmula química do composto desconhecido (X)
corresponde a:
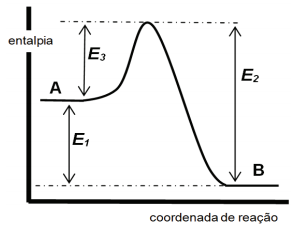 ( ) corresponde à entalpia da reação direta
( ) corresponde à energia de ativação da reação direta
( ) corresponde à entalpia da reação inversa
( ) corresponde à energia de ativação da reação inversa
( ) corresponde à entalpia da reação direta
( ) corresponde à energia de ativação da reação direta
( ) corresponde à entalpia da reação inversa
( ) corresponde à energia de ativação da reação inversa
Assinale a alternativa correta:
Muitas reações químicas inorgânicas podem ser classificadas em reações de síntese ou de análise ou de simples troca ou de dupla troca. Nesse contexto, relacione a COLUNA II com a COLUNA I, classificando as reações químicas.
COLUNA I
1. Reação de síntese
2. Reação de análise
3. Reação de simples troca
4. Reação de dupla troca
COLUNA II
( ) 3 H2(g) + N2(g) → 2 NH3(g)
( ) NaCl + AgNO3 → AgCl + NaNO3
( ) 2 NaN3(s) → 3 N2(g) + 2 Na(s)
( ) 2 Fe(s) + 6 HCl(aq) → 2 FeCl3(aq) + 3 H2(g)
Assinale a sequência correta.
Isótopos radioativos de oxigênio foram utilizados em dois experimentos. No primeiro, foram utilizados para marcar moléculas de dióxido de carbono, enquanto no segundo, esses isótopos foram utilizados para marcar moléculas de água. Em ambos os experimentos, as moléculas marcadas com o isótopo radioativo foram fornecidas a plantas para a realização da fotossíntese.
Após a utilização das moléculas marcadas, pode-se afirmar que os seguintes resultados foram obtidos:
A química ácido / base de muitos sistemas aquáticos naturais, incluindo rios e lagos, é dominada pela interação do íon carbonato, CO3 2-, uma base moderadamente forte, com ácido carbônico (H2 CO3 ), que é um ácido fraco. O ácido carbônico resulta da dissolução na água do gás carbônico e da decomposição da matéria orgânica na água. A fonte predominante de íon carbonato são as rochas calcárias, que são constituídas em grande medida por carbonato de cálcio (CaCO3 ). Embora esse sal seja quase insolúvel, uma pequena quantidade dele dissolve-se quando em contato com a água:
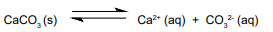
Considere que, em certa condição de temperatura do meio, a constante do produto de solubilidade (Kps) para o CaCO3 seja igual a 4 x 10–10. Nessas condições, qual é a massa de íon cálcio, em miligramas, dissolvida em 100 litros de solução?
Dado: massa atômica do cálcio = 40 u
Assinale a alternativa que apresenta o tipo de radiação
que completa a seguinte equação de desintegração
radioativa hipotética: 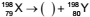 + energia
+ energia
A fórmula estrutural de um hidrocarboneto é representada
a seguir:
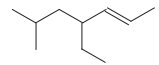
Este hidrocarboneto é nomeado
"A pedra constituída
De ferro, níquel e encanto.
Até o dia de hoje
Provoca tristeza e encanto
Queremos nossa pedra de volta
De volta pro nosso canto."
Cordel: A Saga da Pedra do Bendegó.
A pedra do Bendegó foi encontrada próximo ao riacho de Bendegó, na Bahia, na cidade de Monte Claro, em 1784. Bendegó é um
Em 1897, foi realizado no famoso laboratório de Cavendish, em Cambridge, um experimento usando tubos de raios catódicos. O pesquisador que o executou estava investigando a constituição da matéria.
Este experimento foi feito por
As letras W, X, Y e Z representam átomos de quatro elementos e suas distribuições eletrônicas.
As letras não correspondem aos símbolos dos elementos.
Relacione os elementos às suas respectivas características.
W – 2 : 4
X – 2 : 8 : 1
Y – 2
Z – 2 : 8 : 14 : 2
( ) Gás inerte menos denso que o ar.
( ) Reage com a água, produzindo uma base e gás hidrogênio, liberando grande quantidade de calor.
( ) Metal do quarto período da tabela periódica.
( ) Ametal típico das moléculas orgânicas.
Assinale a opção que mostra a relação correta, segundo a ordem apresentada.
Um laboratório de pesquisa testou alguns compostos antitumorais selecionados quanto à concentração necessária para destruir 50% de uma população de células cancerígenas (IC50). Foram testadas células de leucemia e de melanoma, de acordo com a tabela abaixo:
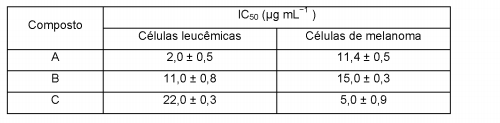
Indique o composto mais eficiente para a destruição de células de melanoma com o respectivo valor de IC50, calculado
em ppm.
