Questões de Concurso
Foram encontradas 3.121 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Com referência a funções orgânicas, julgue o item que se segue.
O grupo dos hidrocarbonetos inclui o subgrupo dos ciclanos,
cuja fórmula geral é CnH2n+2.
Com referência a funções orgânicas, julgue o item que se segue.
O composto 3-buten-1-ol corresponde à seguinte fórmula estrutural.
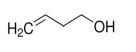
Com referência a funções orgânicas, julgue o item que se segue.
Considerando que a fórmula estrutural a seguir corresponde à molécula de paracetamol, é correto concluir que, no paracetamol, estão presentes as funções orgânicas amina e fenol.
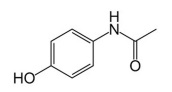
Com base nessa reação química, julgue o próximo item.
O Ca(HCO3)2 é o carbonato de cálcio.
Com relação a essa situação hipotética, julgue o item seguinte, considerando que todos os gases se comportem idealmente, que não haja processo de liquefação ou vaporização e que 0 K = −273 °C.
Se o referido GNV for totalmente transferido para outro
botijão à mesma temperatura e, nesse novo botijão, a pressão
final dos gases for de 30 MPa, então o volume gasoso desse
novo botijão será de 10 m3
.
2 H2O ⇌ 2 H2 + O2
Considerando a reação de eletrólise da água mostrada acima, e sabendo que ZH = 1, ZO = 8, ZP = 15, MH = 1,0 g/mol, MO = 16,0 g/mol e que R = 0,082 atm ∙ L ∙ K−1 ∙ mol−1 é a constante universal dos gases perfeitos, julgue o item que se segue.
Supondo que todo o oxigênio produzido na eletrólise seja
lançado na atmosfera, então, a 1 atm de pressão e 298 K de
temperatura, uma tonelada de água submetida à eletrólise
lançará mais de 500.000 L de oxigênio na atmosfera.
2 H2O ⇌ 2 H2 + O2
Considerando a reação de eletrólise da água mostrada acima, e sabendo que ZH = 1, ZO = 8, ZP = 15, MH = 1,0 g/mol, MO = 16,0 g/mol e que R = 0,082 atm ∙ L ∙ K−1 ∙ mol−1 é a constante universal dos gases perfeitos, julgue o item que se segue.
O oxigênio (O) e o fósforo (P) pertencem ao mesmo grupo
da tabela periódica.
2 H2O ⇌ 2 H2 + O2
Considerando a reação de eletrólise da água mostrada acima, e sabendo que ZH = 1, ZO = 8, ZP = 15, MH = 1,0 g/mol, MO = 16,0 g/mol e que R = 0,082 atm ∙ L ∙ K−1 ∙ mol−1 é a constante universal dos gases perfeitos, julgue o item que se segue.
Segundo a classificação periódica dos elementos, o
hidrogênio é considerado um metal alcalino.
2 H2O ⇌ 2 H2 + O2
Considerando a reação de eletrólise da água mostrada acima, e sabendo que ZH = 1, ZO = 8, ZP = 15, MH = 1,0 g/mol, MO = 16,0 g/mol e que R = 0,082 atm ∙ L ∙ K−1 ∙ mol−1 é a constante universal dos gases perfeitos, julgue o item que se segue.
A reação de eletrólise da água é incompatível com o modelo
atômico de Dalton, segundo o qual, em uma reação química,
os átomos são alterados, pois as propriedades das substâncias
são alteradas.
2 H2O ⇌ 2 H2 + O2
Considerando a reação de eletrólise da água mostrada acima, e sabendo que ZH = 1, ZO = 8, ZP = 15, MH = 1,0 g/mol, MO = 16,0 g/mol e que R = 0,082 atm ∙ L ∙ K−1 ∙ mol−1 é a constante universal dos gases perfeitos, julgue o item que se segue.
Se a fração molar de metano (CH4) no gás natural for igual
a 70%, então, em um botijão de gás natural sob a pressão
de 680 kPa, a pressão parcial do metano será superior
a 500 kPa.
2 H2O ⇌ 2 H2 + O2
Considerando a reação de eletrólise da água mostrada acima, e sabendo que ZH = 1, ZO = 8, ZP = 15, MH = 1,0 g/mol, MO = 16,0 g/mol e que R = 0,082 atm ∙ L ∙ K−1 ∙ mol−1 é a constante universal dos gases perfeitos, julgue o item que se segue.
A pressão da mistura de hidrogênio e gás natural será igual à
soma da pressão parcial do hidrogênio e das pressões
parciais dos gases que compuserem o gás natural.
Acerca da termoquímica, julgue o item subsequente.
Uma reação reversível que seja exotérmica em um sentido
será endotérmica no sentido oposto; se uma reação química
libera calor, ela é exotérmica; se, durante uma reação
química, calor é absorvido do meio, então a reação em
questão é endotérmica.
Julgue o próximo item, relativo à química orgânica.
A composição do petróleo pode ser classificada em função
da presença de hidrocarbonetos, pois o petróleo é uma
mistura complexa de inúmeros compostos orgânicos,
encontrados em poros e fraturas, em geral de rochas
sedimentares.
Julgue o próximo item, relativo à química orgânica.
Os n-alcanos, os quais apresentam a fórmula geral CnH2n+2,
em que n representa um número inteiro positivo, possuem a
cadeia aberta e sem ramificações, com ligações simples entre
seus átomos; os alcanos ramificados também possuem essa
fórmula geral e apresentam cadeia aberta com ramificações.
Considerando as informações apresentadas, julgue o item subsequente.
Considere que a reação de corrosão dos recipientes de ferro (Fe) por ácido clorídrico (HCl) seja descrita pela equação seguinte.
Fe (s) + 2 HCl (l) ⇌ FeCl2 (aq) + H2 (g)
Nessa situação, a reação em tela é um exemplo de equilíbrio
homogêneo.
Considerando as informações apresentadas, julgue o item subsequente.
Os sistemas dispersos podem ser corretamente classificados
em soluções, soluções coloidais e suspensões, conforme o
tamanho das partículas.
Considerando as informações apresentadas, julgue o item subsequente.
Se a concentração dos íons Fe+2 dissolvidos em 50 mL da
água emulsionada for de 0,05 g/L, então o volume de água a
ser adicionado à emulsão para que essa concentração se torne
0,025 g/L é de 10 mL.
O primeiro modelo atômico que, baseado em método científico, explicou a natureza elétrica da matéria foi proposto por John Dalton, no século XIX.
Tendo como referência o assunto tratado no texto precedente, julgue o item que se segue.
Em reações reversíveis, a transformação de reagentes em
produtos continua a acontecer mesmo depois de atingido o
estado de equilíbrio químico.
Tendo como referência o assunto tratado no texto precedente, julgue o item que se segue.
Considere que o dióxido de enxofre (SO2) liberado na atmosfera sofra oxidação ao reagir com o gás oxigênio (O2), produzindo SO3, de acordo com a reação demonstrada a seguir, e que a reação tenha atingido o estado de equilíbrio.
2 SO2 (g) + O2 (g) ⇌ 2 SO3 (g)
Nesse caso, o estado de equilíbrio em questão pode ser
alterado pela variação da pressão atmosférica.