Questões de Concurso
Foram encontradas 3.145 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Assinale a opção que apresenta duas variedades alotrópicas de estrutura cristalina.
TE (H2O) = +100 °C TE (H2S) = −60 °C
Essas diferenças entre as temperaturas de ebulição das substâncias podem ser explicadas pela(o)
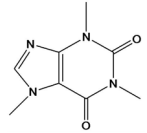
A cafeína é um alcalóide do grupo das xantinas, é um poderoso estimulante presente em cafés, chás e alguns tipos de medicamentos e refrigerantes. Após observar atentamente a fórmula estrutural da cafeína representada abaixo, pode-se afirmar que, EXCETO:
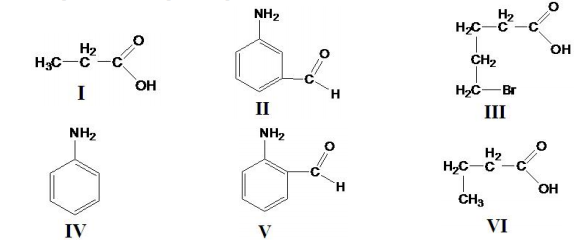
Roberto R. da Silva, et al. A química e a conservação dos dentes, Quím. Nov. na Esc.; N° 13, maio 2001.
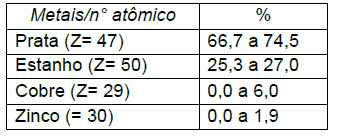
Em relação aos metais presentes nas ligas e a tabela periódica é CORRETO a firmar:
Desejando-se preparar um solução tamponada com pH 10,0, utilizando-se ácido bórico e borato de sódio, e sendo, para ácido bórico o pKa 9,24, calcule a razão, entre a base conjugada e o ácido, necessária para a preparação deste tampão.
O valor correto resultante do cálculo é
Sendo o Ka do ácido acético é 1,75 x 10-5 , calcule a concentração da solução de ácido acético e o pH após a adição de 18,00 ml de NaOH.
Os valores encontrados são, respectivamente,
Em relação ao processo de separação assinale (V), para as afirmativas verdadeiras, e (F), para as falsas.
( ) Na separação por precipitação, todos os precipitados formados precipitam rapidamente. ( ) Os compostos com íon cloreto são sempre solúveis, não sendo adequados para separação por precipitação. ( ) A separação por extração é estabelecido por um equilíbrio governado pela lei de distribuição do analito entre duas fase líquidas miscíveis. ( ) Na separação de íons metálicos, podem ser utilizados agentes quelantes, para formar complexos neutros altamente solúveis em água e praticamente insolúveis em solventes orgânicos.
A sequência correta, de cima para baixo, é
Com base no exposto, são feitas as seguintes afirmações:
I. Os indicadores são compostos adicionados que sofrem uma alteração de cor ou turbidez sinalizando que o ponto final foi atingido. II. Os requisitos de um padrão primário são: alta pureza, baixa solubilidade no meio de titulação, massa molar razoavelmente alta e estabilidade à atmosfera. III. O ponto final de uma titulação de 1,00 mol de HCl é alcançado com a adição de 1,00 mol de Mg(OH)2.
Está(ão) corretas(s) a(s) afirmativa(s)
Os grupos das aulas experimentais de Química utilizaram titulação de complexação para determinar a concentração de ferro numa amostra. Os resultados obtidos estão na Tabela abaixo.

Após a realização do cálculo é correto afirmar que a concentração média e o desvio-padrão de ferro na amostra são, respectivamente,
pH = –log10[H+]
Considerando que uma amostra de sangue apresenta uma concentração iônica [H+] de 100,61 × 10–8 mol/L, qual é o pH dessa amostra de sangue?
As reações a seguir representam o sistema de tamponamento sanguíneo do bicarbonato.
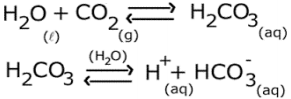
De acordo com as reações, o aumento de CO2 no sangue
resulta em
Observe a figura que representa as informações sobre o elemento químico sódio, presente na tabela periódica.
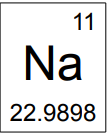
Os números apresentados acima e abaixo do símbolo do
sódio são, respectivamente:
O espectro abaixo foi obtido por espectroscopia UV-Visível.
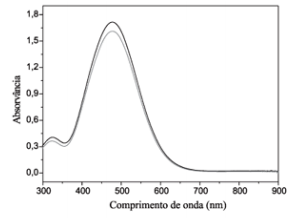
Assinale a alternativa correta que apresenta a
solução e o comprimento de onda máximo
(λmáx), respectivamente, que correspondem ao
espectrograma apresentado acima.
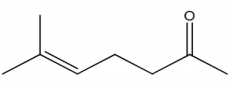
A figura abaixo apresenta a fórmula molecular de um composto encontrado no extrato de jasmim. Assinale a alternativa correta que contém a nomenclatura e família deste composto, respectivamente.
A figura seguinte representa o processo de eletrólise empregado na purificação de cobre, no qual por uma solução de sulfato de cobre (CuSO4) passa uma corrente elétrica que promove uma deposição de 8,50 g de cobre no cátodo.
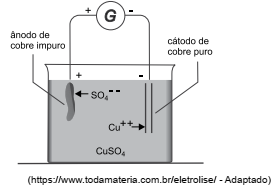
Dados: massas molares Cu=64g; O=16g; S=32g.
Nesse experimento, com base na massa de deposição
de Cobre no cátodo, a massa, em gramas, de sulfato de
cobre (CuSO4) decomposta foi de