Questões de Concurso
Para professor - química
Foram encontradas 4.164 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Dados: massas molares (g.mol-1): S =32; Fe=56.
Se 44kg de sulfeto de ferro(II) contendo impurezas inertes produziram 6,8kg de gás sulfídrico, a porcentagem de pureza desse sulfeto é de
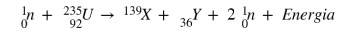
Na reação apresentada, o número atômico de X e o número de massa de Y são, respectivamente,
Adaptado de: https://oglobo.globo.com/saude/medicina/noticia/2023/03. Acesso em 02/04/2023. Analise a estrutura da capsaicina apresentada a seguir.
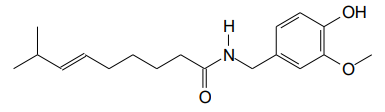
Os grupos funcionais presentes na estrutura que caracterizam as seguintes funções orgânicas:
Considerando a configuração eletrônica do átomo e dos cátions mais comuns desse elemento, é correto afirmar que
O NO produzido na estratosfera pela reação do N2O com o átomo de oxigênio participa da destruição do ozônio na atmosfera.
O NO produzido reage com o ozônio abstraindo um átomo de oxigênio, produzindo o NO2.
Para determinar a expressão da velocidade da reação do NO com o ozônio foram realizados em laboratório, experimentos cujos dados estão na tabela a seguir.
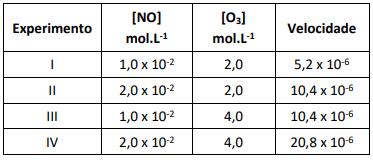
De acordo com os dados, assinale a expressão que descreve a lei da velocidade da reação.
Dado: R = 0,082 atm.L.mol–1. K –1
Um produto químico comum, o tricloroetileno, pode estar associado a um aumento do número de casos de doença de Parkinson no mundo, garante um grupo de cientistas internacionais. Este composto é um solvente usado para descafeinar café, desengordurar metais e lavar roupas a seco.
Adaptado de: https://oglobo.globo.com/saude/medicina/noticia/2023. Acesso em 02/04/2023.
Assinale a opção que indica a fórmula molecular do produto químico citado no texto.
O alumínio é comumente encontrado na natureza formando minerais, como a criolita (Na3AℓF6). Esse mineral apresenta brilho vítreo e sua cor varia de incolor a branco.
Um processo industrial que utiliza a eletrólise ígnea da criolita, usa uma carga de 1 x 106 Faradays.
Nesse processo, a quantidade de alumínio metálico produzido corresponde, aproximadamente, a
Dados: 1F = 96500C, Massa molar Aℓ = 27 g.mol–1
Sobre os processos de nitrificação e desnitrificação, analise as afirmativas a seguir e assinale (V) para a verdadeira e (F) para a falsa.
( ) Na nitrificação, o nox do nitrogênio varia de -3 para +5.
( ) Na desnitrificação, o nox do nitrogênio varia de +5 para +3. ( ) Na desnitrificação, em um dos compostos formados, o nitrogênio apresenta nox zero.
As afirmativas são, respectivamente,
O ciclo hidrológico, representado a seguir, é a circulação da água entre a atmosfera, a hidrosfera, a biosfera e a litosfera, que ocorre a partir de trocas de energia.
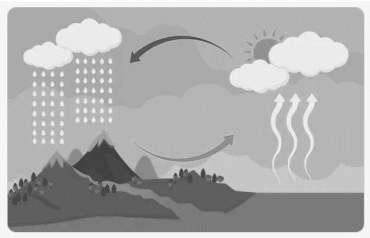
Adaptado de: https://brasilescola.uol.com.br/geografia/ciclo-agua.htm.Acesso em 15/04/2023.
A passagem da água de um corpo d’água para a atmosfera e a
posterior formação de nuvens são fenômenos denominados,
respectivamente, como
Assinale a opção que indica os ácidos causadores da diminuição do pH da chuva.
A variação de entalpia da reação de produção do carbureto de cálcio é igual a
I. sulfato de alumínio é adicionado para retirar partículas leves que estão em suspensão. II. as partículas leves aglutinadas se depositam no fundo do tanque. III. os flocos formados são separados da fase líquida. IV. os flocos que não foram separados na etapa anterior são retidos em camadas de areia, cascalho e carvão.
https://blog.brkambiental.com.br/etapas-tratamento-de-agua/. Acesso em 11/04/2023
Os processos I, II, III e IV são nomeados, respectivamente, como
O quadro a seguir apresenta as concentrações de cinco soluções ideais obtidas com diferentes solutos totalmente dissociados.
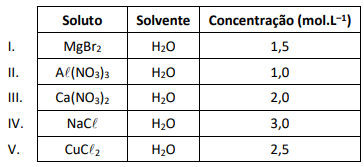
A solução que apresenta a menor pressão de vapor é a
Zn (s) + 2MnO2 (aq) + 2NH4+ (aq) → Zn2+ (aq) + Mn2O3 (s) + 2NH3 (g) + H2O (ℓ) Essa pilha não é recarregável e deixa de funcionar quando todo o dióxido de manganês é consumido. Sobre o funcionamento da pilha de Leclanché, analise as afirmativas a seguir.
I. No anodo ocorre a oxidação do zinco, liberando dois elétrons. II. No cátodo ocorre a redução do manganês, liberando dois elétrons. III. No polo negativo, o íon amônio sofre oxidação.
Está correto o que se afirma em
Assinale a opção que indica a reação de obtenção desse polímero, a partir de seu monômero.
Considerando o sal comum formado apenas por cloreto de sódio, a quantidade máxima de sal que pode ser utilizada por dia, por pessoa, segundo a OMS é de, aproximadamente,
Dados: massas molares (g.mol-1): Na =23; Cℓ =35,5.
FARIAS,R.F. Introdução à Química Forense. 3ª edição. Campinas, SP: Editora Átomo, 2010. p. 38-39 (adaptado).
Considere o pH 6,0 da urina um valor dentro dos padrões. A urina de um indivíduo que sofre de anorexia, após consumo de anfetamina, pode ter
Assinale a opção que indica o valor da constante de equilíbrio em função das pressões.

O gás CO2 de um extintor de incêndio é mais denso do que o ar. À medida que o CO2 sai do extintor, resfria-se significativamente. O vapor d´água no ar é condensado pelo CO2 frio e forma uma nuvem branca.
O fator que faz com que o gás que sai do extintor seja mais denso que o ar é a