Questões de Concurso
Para química
Foram encontradas 13.144 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
A solução de sulfato de cobre penta-hidratado possui 0,9988 g e a massa molar é 249,7 g/mol, já o KIO3 possui massa molar igual a 214,0 g/mol.
Qual a massa de KIO3, em gramas, necessária para que ocorra a precipitação?
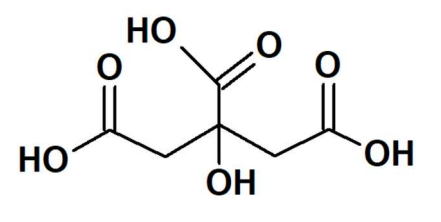
A descrição acima refere-se à/ao:
Para se determinar o teor percentual massa/volume (% m/V) em um determinado limão, coletou-se 2,0 mL do sumo deste limão e titulou-se, em triplicata, através de técnica adequada, com solução padronizada de NaOH 0,110 mol L-1 na presença de indicador fenolftaleína até atingir o ponto de equivalência. Gastou-se, em média, 12,0 mL da base. Desta forma, o valor calculado para o teor % (m/V) de ácido cítrico no limão é igual a
CH3COOH(aq) ⇄ CH3COO- (aq) + H+ (aq)
Dado: pH = -log [H+]
Suponha que foi preparada, em laboratório, uma solução aquosa de ácido acético 0,2 mol L-1. O pH dessa solução possui valor aproximado de
Cu(s) + HNO3(aq) → Cu(NO3)2(aq) + NO(g) + H2O(l)
Balanceando-se a equação de oxirredução acima com algarismos inteiros, determina-se que o somatório de todos os seus coeficientes estequiométricos é igual a
Ag+ (aq) + e- (aq) → Ag(s) E° = 0,80 V Mg2+(aq) + 2e- (aq) → Mg(s) E° = -2,37 V
Determina-se que o potencial padrão da célula em volts, a 25 °C, é
Br2(aq) + HCOOH(aq) → 2Br- (aq) + 2H+ (aq) + CO2(g)
Sabendo-se que a concentração inicial do bromo é 0,120 mol L-1 e que, após 200 s, diminui para 0,060 mol L-1 , determina-se que a constante de velocidade da reação, em s-1, é igual a
( ) O local de armazenar deve ser preferencialmente nas bancadas do laboratório. ( ) O local pode ser iluminado, porém deve ser bem fechado.
( ) As instalações elétricas devem ser à prova de explosões.
1 - Utilizado para aquecimento de líquidos inflamáveis contidos em um balão de fundo redondo. 2 - Utilizado para separação de misturas imiscíveis do tipo sólido-líquido.
3 - Utilizado para secagem de materiais em geral, principalmente vidrarias.
( ) Centrífuga. ( ) Manta aquecedora.
( ) Estufa.
1 - Banho maria. 2 - Balança semianalítica.
3 - Balança analítica.
_____________________ usada para determinar a massa dos produtos e amostras.
_____________________ apresenta precisão menor que a balança analítica.
___________________ com auxílio de um termostato, regula-se a temperatura da água.