Questões de Concurso
Para química
Foram encontradas 13.095 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
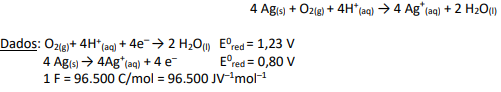
O valor da variação de energia livre, ∆G0 e a espontaneidade da reação é:
(CH3)3CBr + OH– → (CH3)3COH + Br–
Considerando os dados apresentados, a lei de velocidade para a reação é:
I. A velocidade de uma reação depende da concentração, mas a constante de velocidade não depende dela.
II. Quanto mais baixa for a energia de ativação, mais lenta a reação.
III. Se a velocidade de aparecimento de O2(g), 2 O3(g) → 3 O2(g), é 9 x 10–4 mol/L em determinado instante, a velocidade de desaparecimento do O3(g) é 18 x 10–4 mol/L.
Está correto o que se afirma em
I. Na reação química As2S3 + HNO3 + H2O → H3AsO4 + H2SO4 + NO, o nitrogênio sofre redução.
II. Na reação Cl2(g) + NaOH(aq) → NaCl(aq) + NaClO(aq) + H2O(l), o cloro sofre, ao mesmo tempo, oxidação e redução, tratando-se, nesse caso, de uma reação de auto-oxirredução.
III. Na equação química MnO4- + Fe2+(aq) + H+ (aq) → Mn2+(aq) + H2O + Fe3+(aq), a soma dos menores valores inteiros dos coeficientes estequiométricos é 24.
Está correto o que se afirma em
I. Na eletrólise do sulfato de sódio, a água é mais facilmente oxidada no ânodo do que o SO4- e no catodo as moléculas de água são reduzidas mais facilmente que os íons sódio.
II. Na eletrólise do cloreto de sódio fundido, pode-se obter Cl2(g) no ânodo.
III. Na eletrólise de uma solução aquosa de NaF, o F– será reduzido.
Está correto o que se afirma em
Fe2+(aq) + 2 e– → Fe(s) Eo = – 0,44 V
Zn2+(aq) + 2 e– → Zn(s) Eo = – 0,76 V
Com base nos dados de potencial-padrão de redução das semirreações, marque V para as afirmativas verdadeiras e F para as falsas.
( ) O zinco é mais facilmente oxidado e serve como ânodo.
( ) O ferro funciona como cátodo.
( ) O potencial desta pilha é 1,2 V.
( ) O ∆Eo < 0 caracteriza o funcionamento espontâneo da pilha.
A sequência está correta em
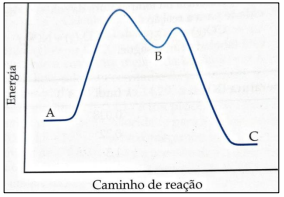
De acordo com o gráfico, analise as afirmativas a seguir.
I. Existe um intermediário B na reação A → C.
II. A reação total é exotérmica.
III. A etapa B → C é mais rápida.
Está correto o que se afirma em
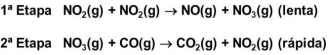
I. O intermediário NO3(g) é produzido lentamente na etapa 1 e é imediatamente consumido na etapa 2.
II. A lei de velocidade da reação é V = K [NO2]2 .
III. A etapa 2 é muito mais rápida que a etapa 1, isto é K2>>K1.
Está correto o que se afirma em
( ) Para a reação PCl5(g) ⇌ PCl3(g) + Cl2(g) ∆H0= 87,9 kJ, o equilíbrio se deslocará para direita quando a temperatura for diminuída.
( ) Para a reação N2O4(g) ⇌ 2NO2(g), o equilíbrio se deslocará para direita com o aumento da pressão total pela adição de N2(g).
( ) A remoção de H2O, 4 NH3(g) + 3O2(g) ⇌ 2 N2(g) + 6H2O(g), reduz Q abaixo de K, com formação de produtos à custa dos reagentes.
( ) Na reação 2 SO2(g) + O2(g) ⇌ 2 SO3(g), o equilíbrio se desloca no sentido de formação do produto, com o aumento da concentração de SO2(g).
A sequência está correta em
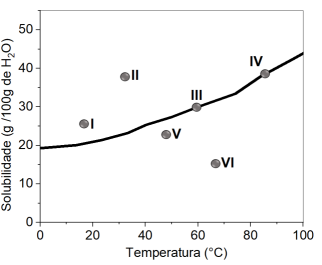
A partir da análise do perfil de solubilidade do sal, é correto afirmar que ocorre a formação de precipitado apenas nos seguintes sistemas:
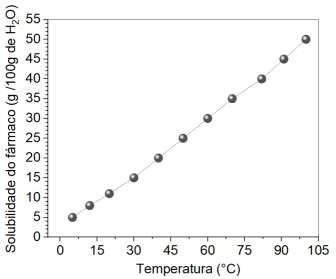
Se o químico optar por trabalhar com 40 g de água a 60°C, a quantidade máxima da substância que será dissolvida é:
AB(s) ⇌ A+ (aq) + B− (aq)
É correto afirmar que a solução saturada do sal, a 25°C, apresentará a seguinte concentração: