Questões de Concurso
Para química
Foram encontradas 13.134 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Julgue o seguinte item, em relação à eletroquímica.
O potencial da semirreação representada a seguir não depende do pH.
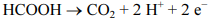
Julgue o seguinte item, em relação à eletroquímica.
Os potenciais-padrão das semirreações de oxirredução são
medidos com base no eletrodo-padrão de hidrogênio, cujo
valor estabelecido é 0,00 V.
Julgue o seguinte item, em relação à eletroquímica.
Considerando-se os potenciais de redução 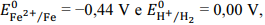 é correto afirmar que
um prego de ferro colocado em uma solução de HCl 1 mol/L
permanece em seu estado inalterado.
é correto afirmar que
um prego de ferro colocado em uma solução de HCl 1 mol/L
permanece em seu estado inalterado.
Segundo a IUPAC, a dupla barra vertical na notação das pilhas eletroquímicas representa a ponte salina.
( ) A difusão nos sólidos metais dominantes são a difusão por lacunas e a difusão intersticial.
( ) No interior dos sólidos, a difusão ocorre por movimentação atômica de cátions e ânions no caso dos polímeros e das macromoléculas no caso dos metais.
( ) Para ocorrer a movimentação de átomos são necessárias duas condições: Uma delas ´a existência de um espaço livre adjacente ao átomo. A outra é a de que o átomo deve possuir energia suficiente para quebrar as ligações químicas que o une a seus átomos vizinhos e então causar uma distorção no reticulado cristalino durante seu deslocamento.
Assinale a alternativa que apresenta a sequência correta de cima para baixo.
( ) Um material cristalino é aquele no qual os átomos estão posicionados segundo um arranjo periódico ou repetitivo ao longo de grandes distâncias atômicas.
( ) A ligação cristalina dos metais é de natureza direcional o que dá a robustez dessa classe de materiais.
( ) As células unitárias para a maioria das estruturas cristalinas são tetraedros com conjuntos de faces perpendiculares.
Assinale a alternativa que apresenta a sequência correta de cima para baixo.
“O presidente da Belarus, Alexander Lukashenko, afirmou que as nações que estão dispostas a ‘se juntar ao Estado da União da Rússia e da Belarus’ receberão armas nucleares. A utilização de armas nucleares ainda preocupa o mundo, já que estes dispositivos liberam enormes quantidades de energia de maneira explosiva, por meio de reações de fissão nuclear ou de fissão nuclear e fusão nuclear combinadas”.
Adaptado de: https://www.cnnbrasil.com.br/internacional/lukashenko-oferece-armas-nucleares-a-nacoes-dispostas-a-integrar-estado-da-uniao-da-russia-e-da-belarus/
Podemos dizer que os átomos são formados apenas por prótons, elétrons e nêutrons, sob a ótica quântica. Dessa maneira, assinale a alternativa que contém o nome do descobridor de cada partícula atômica, respectivamente:
Considerando a equação de equilíbrio a 160 °C
PCl5(g) ←→ PCl3(g) + Cl2(g)
Foi realizado um experimento, à mesma temperatura, e após o equilíbrio determinaram-se as seguintes concentrações:
[PCl5] = 0,027 mol.L-1
[PCl3] = 0,046 mol.L-1
[Cl2] = 0,012 mol.L-1
Desse modo, pode-se dizer que o valor da constante Kc corresponde, aproximadamente, a:
“Em uma solução ácida a concentração de íons hidrogênio (hidrônio) é maior do que a de íons hidróxido”.
Considerando uma solução de HCl de concentração 4,6.10-3 mol.L-1 (log 4,6 = 0,66), a alternativa que indica o pH e o pOH corretamente é:
(RUSSEL, Química Geral, vol. 2, Editora Pearson, 1994)
Os alcenos podem apresentar isômeros geométricos devido a sua ligação dupla entre átomos de carbono. “A ausência de rotação em torno da ligação dupla carbono-carbono tem consequências químicas, além do interesse teórico”. Quando os carbonos das ligações duplas possuem apenas dois tipos de substituintes, usa-se a nomenclatura cis-trans para diferenciar seus isômeros. Para os carbonos das ligações duplas trissubstituídas e tetrassubstituídas, usa-se o sistema de nomenclatura E, Z, proveniente dos termos alemães entgegen e zusammen. Considerando as duas estruturas a seguir, os nomes corretos a serem atribuídos, respectivamente, são:
(MCMURRY, Química Orgânica.Editora Cengage Learning, 2011)
O Brasil já possui quase 5.000 tipos de agrotóxicos liberados pelo governo federal, por meio do Ministério da Agricultura, Pecuária e Abastecimento. Leia, a seguir, uma notícia veiculada sobre a liberação de agrotóxicos em 2021.
APÓS NOVO RECORDE, BRASIL ENCERRA 2021 COM 562 AGROTÓXICOS LIBERADOS, SENDO 33 INÉDITOS
Registros de defensivos cresceram 14% em relação a 2020. Aprovações vêm aumentando desde 2016.
O Brasil encerrou 2021 com 562 agrotóxicos liberados, maior número da série histórica iniciada em 2000 pelo Ministério da Agricultura. Ainda em dezembro, o total de aprovações já tinha superado o recorde de 2020.
As últimas liberações de 2021 foram publicadas em janeiro no Diário Oficial da União (DOU).
O volume foi 14% superior ao de 2020, quando 493 pesticidas foram autorizados. Os registros vêm crescendo ano a ano no país desde 2016.
https://g1.globo.com/economia/agronegocios/noticia/2022/01/18/apos-novo-recorde-brasilencerra-2021-com-562-agrotoxicos-liberados-sendo-33-ineditos.ghtml
O glifosato é o agrotóxico mais vendido no Brasil. Ele é um herbicida sistêmico de amplo espectro e dessecante de culturas. Suas fórmulas estrutural e molecular são apresentadas abaixo:
C3H8NO5P
Considerando a estrutura apresentada, a alternativa que contém corretamente as funções orgânicas presentes na sua estrutura molecular é:
Um estudante, em laboratório, e utilizando corretamente equipamentos de proteção individual, organizou todos os reagentes e vidrarias necessários para realizar uma titulação. Em um Erlenmeyer, ele adicionou 25 mL de uma solução de ácido oxálico, H2C2O4, que possui dois hidrogênios ionizáveis. Na bureta, o titulante por ele utilizado foi o NaOH(aq) com concentração 0,1 mol.L-1. Ao realizar, cuidadosamente, a titulação, o ponto estequiométrico foi atingido após a adição de 38 mL da solução básica. Portanto, a concentração em mol.L-1 do ácido oxálico é:
“Os compostos de coordenação estão presentes na maioria dos processos químicos que envolvem espécies inorgânicas em temperaturas não muito elevadas. Sob o ponto de vista de estabilidade térmica, alguns são estáveis apenas em baixas temperaturas e outros mantêm suas identidades mesmo a altas temperaturas, podendo, até ser volatilizados. Alguns dos que têm elementos de transição como átomo central são paramagnéticos, enquanto os que têm elementos representativos como átomo central são sempre diamagnéticos. Além disso, muitos dos que se formam pelos metais de transição são coloridos; já os formados pelos elementos representativos são brancos, a não ser que se formem com ligantes coloridos”. A alternativa que associa cada composto ao seu nome de forma CORRETA é:
(FARIAS, Química de Coordenação: fundamentos e atualidades, Editora Átomo, 2009)
I - [Ag(NH3)2]+ |
A - Triacetonitrilatriclorocobalto (Ill) |
II - [Co(NH3)6]3+ |
B - Tetracianoplatinato (II) |
III - [Ag(NH3)2]Cl |
C - Hexaminocobalto (III) |
IV - [Co(an)3Cl3] |
D - Cloreto de diaminoprata (I) |
V - [Pt(Cn)4]2- |
E - Diaminoprata (I) |
A Lei de Faraday da eletrólise enuncia que “a quantidade do produto formado ou do reagente consumido por uma corrente elétrica é estequiometricamente equivalente à quantidade de elétrons fornecidos”. Pode-se afirmar, portanto, que a quantidade (em mols) de Al(s) que pode ser produzida a partir do alumínio no composto Al2O3, se 5 mols de elétrons forem fornecidos, é aproximadamente:
(ATKINS; JONES, Princípios de Química: questionando a vida moderna e o meio ambiente, Editora Bookman, 2006)
“A meia-vida, t1/2, de uma substância é o tempo necessário para que sua concentração caia à metade do valor inicial”. A figura abaixo mostra a concentração do cloreto de butila (C4H9Cl) como uma função do tempo:
(ATKINS; JONES, Princípios de Química: questionando a vida moderna e o meio ambiente, Editora Bookman, 2006)
Variação da Concentração com o Tempo
Fonte: BROWN; LEMAY; BURSTEN, Química: a ciência central, São Paulo: Pearson Prentice Hall, 2005, p. 487
Pode-se concluir, observando o gráfico, que a meia-vida da reação de C4H9Cl com água ocorre aproximadamente no tempo de:
“A energia livre de Gibbs é uma grandeza termodinâmica notável”. A entropia é considerada uma função de estado assim como a entalpia. Considerando a síntese da amônia a partir de N2(g) e H2(g) a 298 K conforme equação a seguir:
(BROWN; LEMAY; BURSTEN, Química: a ciência central, São Paulo: Pearson Prentice Hall, 2005, p. 702)
N2(g) + 3 H2(g) → 2 NH3(g)
E conhecendo as informações do quadro abaixo:
Substância |
ΔHºf(kJ.mol-1) |
Sº (J.mol-1.k-1) |
N2(g) |
0 |
191,5 |
H2(g) |
0 |
130,6 |
NH3(g) |
–80,3 |
111,3 |
Podemos afirmar, com base nos dados apresentados, que o valor da variação da energia livre de Gibbs para a síntese da amônia, em kJ.mol-1, é aproximadamente:
Algumas substâncias em soluções podem modificar o ponto de ebulição ou de congelamento em relação ao solvente puro. “A redução do ponto de congelamento e o aumento do ponto de ebulição são propriedades físicas das soluções que dependem da quantidade (concentração), mas não do tipo ou identidade das partículas do soluto. Tais propriedades são chamadas propriedades coligativas”. Considerando o ponto de congelamento do etanol igual a -114,6 °C e, para essa temperatura, a constante crioscópica (Kc) 1,99 °C.mol. kg-1, o ponto de congelamento de uma solução contendo 0,5 kg de C2H5OH e 77 g de eucaliptol (C10H18O), uma substância encontrada na folha do eucalipto, será:
(BROWN; LEMAY; BURSTEN, Química: a ciência central, São Paulo: Pearson Prentice Hall, 2005)
A reação entre 0,20 mol.L-1 de N2 (g) com 0,20 mol.L-1 de H2 (g) resulta em 0,60 mol.L-1 de NH3 (g) quando atingido o equilíbrio químico. Considerando que a reação química ocorre em condições normais de temperatura e pressão, assinale a alternativa que indica o valor correto da Constante de equilíbrio em função da concentração (Kc) nessas condições.
Considere a equação química não balanceada: N2 (g) + H2 (g) ↔ NH3 (g)
O preparo de soluções é uma das práticas mais comuns e importantes nos laboratórios de química. Soluções podem ser preparadas a partir de um soluto sólido ou a partir de uma solução concentrada em estoque desse soluto. Considere uma solução de nitrato de prata (AgNO3) em estoque que possui percentual em massa de 70% e densidade de 4,35 g.mL-1. Dada a massa molar: AgNO3 = 170 g.mol-1, para preparar 250 mL de uma solução aquosa de AgNO3 com concentração de 0,2 mol.L-1, é necessário retirar um volume da solução estoque de: