Questões de Vestibular de Química - Termoquímica: Energia Calorífica, Calor de reação, Entalpia, Equações e Lei de Hess.
Foram encontradas 343 questões
I. C(graf) + O2(g) → CO2(g) ΔH°= – 394 kJ/mol
II. H2(g) + 1/2 O2(g) → H2O(ℓ) ΔH° = – 242 kJ/mol
III. C(graf) + 2 H2(g) → CH4(g) ΔH° = – 74 kJ/mol
IV. 2 C(graf) + 3 H2(g) + 1/2 O2(g) → C2H5OH(ℓ) ΔH° = – 278 kJ/mol
É correto afirmar que
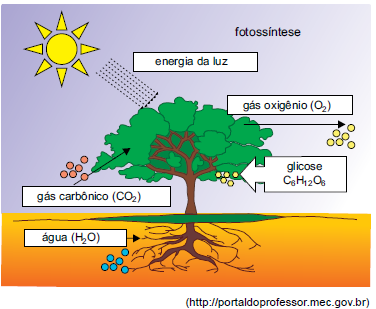
É correto afirmar que a fotossíntese é uma reação
Os valores das entalpias-padrão de formação, como os apresentados na tabela, podem ser utilizados para prever a variação de entalpia associada a uma reação química, a exemplo da desidratação intramolecular do etanol, na presença do ácido sulfúrico, que leva à formação do eteno e da água, de acordo com a reação representada pela equação química
C2H6O(ℓ) → C2H4(g) + H2O(ℓ)
Considerando-se essas informações e os valores das entalpias-padrão de formação do eteno, do etanol e da água, relacionados na tabela, é correto afirmar:
2 C(graf) + 3 H2(g) + 1/2 O2(g) → C2H6O(l) ΔHf = ?
Energeticamente, a entalpia padrão de formação do etanol pode ser determinada através de 3 diferentes equações de combustão. As equações estão representadas abaixo:
C(graf) + O2(g) → CO2(g) ΔHf = -394 kJ mol-1
H2(g) + 1/2 O2(g) → H2O(l) ΔHf = -286 kJ mol-1
C2H6O(l) + 3 O2(g) → 2 CO2(g) + 3 H2O(l) ΔHf = -1368 kJ mol-1
Baseado nos dados acima, qual o ΔHf do etanol, em kJ.mol-1?