Questões de Vestibular de Química - Termoquímica: Energia Calorífica, Calor de reação, Entalpia, Equações e Lei de Hess.
Foram encontradas 343 questões
1 N2(g) + 3 H2(g) ⇌ 2 NH3(g) ∆H = –17 kcal/mol
A respeito desse equilíbrio, assinale a afirmativa incorreta.
I. Decomposição do mármore: CaCO3(s) →CaO(s) + CO2(g)
II. Produção do gás hidrogênio a partir do metano: CH4(g) + H2O(v) → CO(g) + 3H2(g)
III. Oxidação da sacarose: C12H22O11(s) + 12 O2(g) → 12 CO2(g) + 11 H2O(l)
Dados:
Tabela – Entalpia padrão de formação de algumas substâncias a 25 ºC e 1 atm.
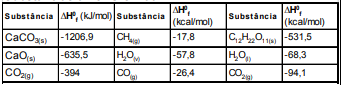
Calcule, a partir dos dados acima, a variação de entalpia das reações e assinale a opção correta:
Considere a equação termoquímica abaixo representada:
S(g) + 3/2 O2(g) -> SO3(s)
∆H= -94,4 kcal/mol
Podemos afirmar que, na formação de 200 g de trióxido de enxofre:
(I) H2O(l) → H2(g) + 1/2O2(g) ∆H = +286 kJ (II) H2(g) + ½ O2(g) → H2O(g) ∆H = - 242 kJ (III) H2O(l) → H2O(s) ∆H = - 7,3 kJ
De acordo com as equações acima e os seus conhecimentos de química, é incorreta a afirmativa: