Questões de Vestibular de Química - Termoquímica: Energia Calorífica, Calor de reação, Entalpia, Equações e Lei de Hess.
Foram encontradas 343 questões

Apressão de vapor é uma importante propriedade físico-química das substâncias e das soluções.
Com base nos dados fornecidos e nos conhecimentos de química, é correto afirmar:
As propriedades físico-químicas das substâncias são afetadas pelas interações intra e intermoleculares.
Com base nos conhecimentos de química e nos dados da tabela, é correto afirmar:
A entalpia normal de vaporização do metanol é maior que a do metano.
C6H4(OH)2(aq) + H2O2
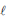 ) hidroquinona
) hidroquinona O calor envolvido nessa transformação pode ser calculado, considerando-se os processos:
C6H4(OH)2(aq) → C6H4O2(aq) + H2(g) ΔHº = + 177 kJ . mol-1
H2O (
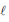 ) + 1/2 O (g) → H2O2 (aq) ΔHº= + 95 kJ .mol-1
) + 1/2 O (g) → H2O2 (aq) ΔHº= + 95 kJ .mol-1
H2O(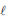 ) → 1/2 O2(g) + H2 (g) ΔHº= + 286 kJ .mol-1
) → 1/2 O2(g) + H2 (g) ΔHº= + 286 kJ .mol-1
I. CH4(g) + 2O2(g) → CO2(g) + 2H2O(g) ΔHo= −212,8kcalmol−1 II. CH4(g) + 2O2(g) → CO2(g) + 2H2O(l)
( ) A partir dos métodos do calor de formação e da energia de ligação, obtêm-se os mesmos valores de variação de entalpia da reação expressa na equação química I. ( ) A queima de alcanos só é exotérmica se os produtos forem gasosos. ( ) A reação expressa na equação química II é mais exotérmica que aquela expressa na equação química I. ( ) O calor da reação expressa na equação química II equivale à soma do calor de vaporização da água com o calor envolvido na reação expressa na equação química I.
A alternativa que contém a sequência correta, de cima para baixo, é a
Sob certas condições, tanto o gás flúor quanto o gás cloro
podem reagir com hidrogênio gasoso, formando,
respectivamente, os haletos de hidrogênio HF e HCl,
gasosos. Pode-se estimar a variação de entalpia 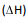 de cada
uma dessas reações, utilizando-se dados de energia de
ligação. A tabela apresenta os valores de energia de ligação
dos reagentes e produtos dessas reações a 25 ºC e 1 atm.
de cada
uma dessas reações, utilizando-se dados de energia de
ligação. A tabela apresenta os valores de energia de ligação
dos reagentes e produtos dessas reações a 25 ºC e 1 atm.

Com base nesses dados, um estudante calculou a variação
de entalpia 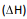 de cada uma das reações e concluiu,
corretamente, que, nas condições empregadas,
de cada uma das reações e concluiu,
corretamente, que, nas condições empregadas,
