Questões de Vestibular Sobre termoquímica: energia calorífica, calor de reação, entalpia, equações e lei de hess. em química
Foram encontradas 343 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO
No tanque de um automóvel, há 30 litros de um combustível composto por gasolina (isoctano) e álcool etílico, numa proporção de 75% para 25%, respectivamente, em volume. Considerando que as reações de combustão ocorram com 100% de rendimento e os dados apresentados abaixo, assinale o que for correto.
1 C2H6O(l) + 3 O2(g) → 2 CO2(g) + 3 H2O(l)
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

No tanque de um automóvel, há 30 litros de um combustível composto por gasolina (isoctano) e álcool etílico, numa proporção de 75% para 25%, respectivamente, em volume. Considerando que as reações de combustão ocorram com 100% de rendimento e os dados apresentados abaixo, assinale o que for correto.
1 C2H6O(l) + 3 O2(g) → 2 CO2(g) + 3 H2O(l)
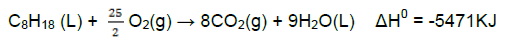
Nestas condições, é CORRETO afirmar que a razão entre as energias gastas em um ano, nessa jornada, pelo automóvel e o estudante na bicicleta, é aproximadamente
C6H12O6(s) + 6 O2 (g) → 6 CO2(g) + 6 H2O(l)
Calcule a entalpia padrão de combustão da glicose sabendo as entalpias padrão de formação:
∆Hf°(C6H12O6,s) = −1.268 kJ∙mol−1 ∆Hf°(CO2,g) = −393,51 kJ∙mol−1 ∆Hf°(H2O,l) = −285,83 kJ∙mol−1
H2(l) + ½ O2(l) → H2O(g), ∆H = -242 kJ.mol-1
Levando-se em consideração a aplicação, e que todo o combustível é consumido, qual é a energia (J) liberada para propulsão do ônibus espacial?