Questões de Vestibular Sobre termoquímica: energia calorífica, calor de reação, entalpia, equações e lei de hess. em química
Foram encontradas 343 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Para a reação de obtenção do CH3CH2Br, têm-se as seguintes informações:
Expressão de equilíbrio:
H2C 
Dados termodinâmicos (a 298 K):
Keq=7,5 x 107
∆H0 = -84,1 kJ mol-1
Ea= 140 kJ mol-1

Com relação às informações acima, assinale a proposição CORRETA.
O valor de ∆H sugere que a reação é endotérmica.
UFSC aprova Instituto Nacional de Ciência e Tecnologia de Catálise em Sistemas Moleculares e Nanoestruturados.
O INCT de Catálise em Sistemas Moleculares e Nanoestruturados terá sua sede no Departamento de Química da UFSC, agregando o trabalho de 15 laboratórios. Receberá nos próximos três anos cerca de R$ 4,7 milhões para o desenvolvimento de pesquisas e estruturação de uma rede nacional formada por mais de 350 membros dos estados de Santa Catarina, Rio Grande do Sul, São Paulo, Minas Gerais, Rio de Janeiro, Alagoas e do Distrito Federal. São pesquisadores sêniores (líderes de grupos em diferentes universidades), mestrandos, doutorandos, pós-doutores e também estudantes de iniciação científica. O INCT pretende estudar o papel de catalisadores na obtenção de plásticos, no biodiesel, em terapias genéticas, dentre outros assuntos.
Disponível em: <http://www.agecom.ufsc.br> Acesso em: 03 set. 2010. (Adaptado)
Sobre o assunto, assinale a proposição CORRETA.
Uma reação endotérmica pode se tornar exotérmica na presença de um catalisador.

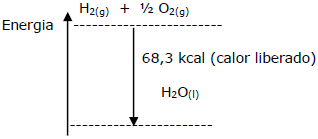
Com relação a esse processo, assinale a equação química correta.
MgO + H2O → Mg(OH)2 + X kcal/mol
Sabendo-se que as entalpias de formação dos compostos envolvidos são a 1atm e 25ºC (condições-padrão):
∆H (MgO) = -152 kcal/mol; ∆H (H2 O) = -68 kcal/mol; ∆H (Mg(OH)2 ) = -240 kcal/mol;
Em relação à reação e o calor envolvido no processo, assinale a alternativa CORRETA.
C(graf) + 2H2(g) → CH4(g)
As reações envolvidas neste processo encontram-se representadas da seguinte forma:
CH4(g) + 2O2(g) → CO2(g) + 2H2O(l) ∆H° = -890,4 kJ/mol C(graf) + O2(g) → CO2(g) ∆H° = -393,5 kJ/mol H2(g) + 1 O2(g)/2 → H2O(l) ∆H° =- 285,8 kJ/mol
Com base nessas reações, verifica-se que o valor da entalpia padrão de formação do CH4(g) é: