Questões Militares
Sobre transformações químicas: elementos químicos, tabela periódica e reações químicas em química
Foram encontradas 310 questões
Adaptado. Disponível em: Cobre: Ocorrência, obtenção industrial, propriedades e utilização - UOL Educação. Acesso: 05 de janeiro de 2022.
Um dos minérios mais utilizados na obtenção do cobre metálico é a calcosita, que pode ser representada pela fórmula Cu2 S. Um método de retirada do enxofre do minério é o processo de ustulação (por meio de aquecimento em presença de ar seco, rico em gás oxigênio). Observe a equação não balanceada a seguir, que representa o processo citado anteriormente:
Cu2S + O2 → Cu + SO2
Após o balanceamento da equação anterior, assinale a alternativa que apresenta qual é a massa aproximada (em gramas) de cobre metálico que pode ser obtida a partir de 2,0 Kg de Cu2S, com 60% de pureza e gás oxigênio suficiente. (Dados: massas atômicas - Cu = 63,5; S = 32).
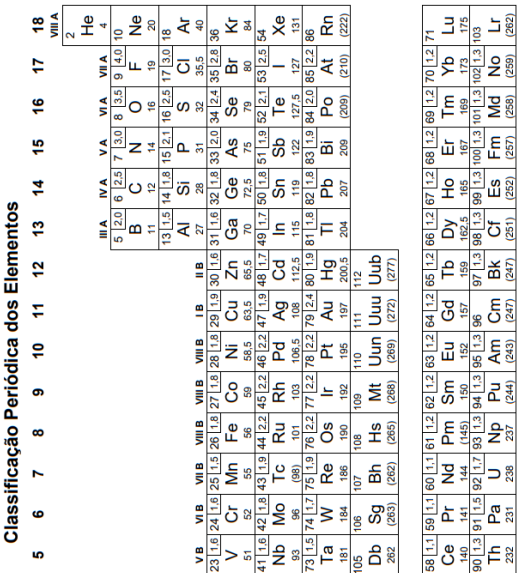
O elemento químico mais eletronegativo, localizado no grupo 17 e no segundo período da Tabela Periódica, tende a formar I de carga II para ficar mais estável e, nessa configuração, sua última camada eletrônica possui III elétrons.
Esse elemento se associa ao hidrogênio, formando uma substância que pode ser usada para criar situações de destruição em massa, uma vez que produz efeitos sistêmicos decorrentes da hipocalcemia, hipomagnesemia e hiperpotassemia, além da possível ocorrência de coagulopatia e arritmias cardíacas fatais. (Disponível em: https://www.msdmanuals.com/pt-br. Adaptado)
Completam, correta e respectivamente, as lacunas I, II e III:
• Sobre volume de meio copo (~100 mL) do extrato líquido, adicionaram-se 20 mL de solução salina de cloreto de sódio (1 mol L -1 ). A cor roxa do extrato foi mantida.
• Sobre volume de meio copo do extrato líquido, adicionou-se suco de um limão. A cor do extrato líquido se tornou vermelha.
Foi observado aspecto opaco (turvo) no extrato líquido logo em seguida à sua separação das folhas de repolho, e esse aspecto se manteve durante todos os experimentos.
Sobre esse experimento, considere as seguintes afirmativas:
1. A mudança de cor de roxa para vermelha no segundo experimento é evidência de que ocorreu uma transformação química no extrato.
2. O extrato líquido é uma mistura homogênea.
3. Nos 20 mL de solução salina existem 1,2 x 1022 íons Na+ e 1,2 x 1022 íons Cl– .
Assinale a alternativa correta.
Uma solução aquosa de cianeto de sódio foi adicionada a uma solução aquosa de permanganato de potássio, em meio básico. Assim, foram formados o óxido de manganês (IV) sólido e o íon cianato, CNO– .
Na semirreação envolvendo um mol do íon cianeto há a participação de ________ elétrons.
No balanceamento da equação global da reação envolvendo 2 mol do íon permanganato, participam _______ de íons hidroxila representados no lado dos _______ da equação de reação.
Assinale a alternativa que preenche, correta e respectivamente, as lacunas do texto.
São apresentadas as configurações eletrônicas no estado fundamental de três elementos químicos:
I. [Ne] 3s2 3p1
II. [Ar]3s2
III. [Ne]3s2 3p5
A respeito desses elementos químicos, é correto afirmar que, dentre eles,
2NH3 + CO2 ➝ NH2C(O)ONH4
NH2C(O)ONH4 ➝ (NH2)2CO + H2O
As etapas são, respectivamente, classificadas como reações de


A diferença entre os diâmetros foi explicada pela presença de prótons e nêutrons no núcleo muito denso e pela disposição de elétrons em camadas na eletrosfera, num modelo atômico planetário.
A esse respeito, analise as afirmativas a seguir.
I. O raio atômico do estrôncio é igual ao raio atômico da prata, pois ambos átomos possuem o mesmo número de camadas eletrônicas.
II. O raio atômico do cálcio é maior do que o raio atômico do bário, pois o cálcio apresenta maior número de camadas eletrônicas.
III. O raio atômico do potássio é maior do que o raio atômico do zinco, pois o potássio tem menor carga nuclear.
Está correto o que se afirma em


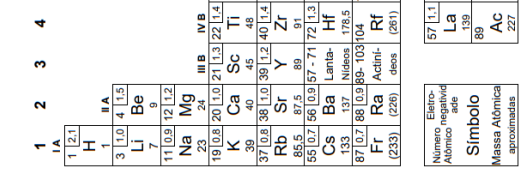
Considere os átomos sódio (Na), potássio (K), ferro (Fe), césio (Cs) e iodo (I).
Nesse conjunto, o átomo que necessita de radiação eletromagnética de menor frequência para a emissão de fotoelétrons é
Considere os elementos:
ósmio – iodo – bário – chumbo
Com base nas posições desses elementos na Classificação Periódica, o elemento de maior densidade e o de menor eletronegatividade são, respectivamente,
A tabela mostra a distribuição eletrônica, em níveis de energia, do átomo do gás nobre argônio, Ar.
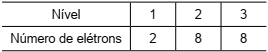
Dois dos íons que apresentam essa mesma distribuição eletrônica são:

( ) Os elementos do Grupo 1A, os metais alcalinos, sofrem reações similares com água e formam compostos do tipo MOH (M= Li, Na, K).
( ) Os elementos do Grupo 2A, os metais alcalinos terrosos, sofrem reações com a água e formam compostos do tipo MOH(M= Mg, Ca, Sr, Ba).
( ) Os elementos do Grupo 7A, os halogênios, sofrem reações similares com metais e outros não metais.
( ) Considerando a família 4A, apenas C e Si reagem com outros elementos para formar compostos semicondutores.
Assinale a sequência correta.
: I- Pb(NO3)2 + K2CrO4 → PbCrO4 + 2 KNO3
II- FeCl3 + 3 NaOH → Fe(OH)3 + 3 NaCl
III- BaNO3 + NaOH → Ba(OH)2 + NaNO3
IV- 2 AgNO3 + K2CrO4 → Ag2CrO4 + 2 KNO3
V- MgCl2 + 2 NaOH → Mg(OH)2 + 2 NaCl
Considerando os produtos de cada reação, somente não formará precipitado na reação:
