Questões Militares
Para farmacêutico industrial
Foram encontradas 50 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Os estudos de pré-formulação farmacêutica preveem várias etapas, EXCETO:
I. A biodisponibilidade de um fármaco pode ser afetada pelo grau de desintegração e dissolução das formas farmacêuticas nos fluidos orgânicos.
II. Fatores que influenciam a absorção de fármacos também podem variar a biodisponiblidade.
III. A biodisponibilidade influencia a resposta clínica e escolha das vias de administração.
No final dos anos 60, a imprensa europeia publicou que um paciente perdeu a visão e outros mais sofreram graves lesões nos olhos que comprometeram seriamente a sua visão. A investigação apontou o fabricante da pomada oftálmica como responsável, porque este produto, por conter antibióticos de amplo espectro e um esteroide, não continha conservantes.O fabricante considerou que a presença de antibióticos e o baixo conteúdo de água eram suficientes para prevenir o crescimento bacteriano. Foram analisadas 60 bisnagas do produto, sendo que 47 apresentaram elevada contaminação por pseudomonas aeruginosa, conforme mostra o quadro abaixo:
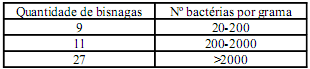
O fato citado evidenciou problemas de fabricação e controle que a indústria deveria corrigir.
Com base nas Boas Práticas de Fabricação, constante na RDC ANVISA n. 210, analise as afirmativas abaixo, relativas a prováveis soluções dentro dos padrões do controle de qualidade.
1. Realizar um número suficiente de testes de controle para verificar se as operações de processamento, fabricação e embalagem permitem alcançar os requisitos de qualidade.
2. Fornecer instruções e tomar as providências necessárias para garantir que os medicamentos sejam armazenados pelo fabricante, distribuídos e subsequentemente manuseados, de forma que a qualidade dos mesmos seja mantida por todo o prazo de validade.
3. Realizar procedimentos de organização, documentação e procedimentos de liberação que asseguram que os ensaios necessários e relevantes sejam executados e que os materiais não sejam liberados para uso, nem os produtos liberados para venda ou fornecimento, até que a qualidade dos mesmos seja julgada satisfatória.
4. Realizar atividades de sanitização e higiene que devem abranger pessoal, instalações, equipamentos e aparelhos, materiais de produção e recipientes, produtos para limpeza e desinfecção e qualquer outro aspecto que possa constituir fonte de contaminação para o produto.
Assinale a opção que melhor se adapta à solução do problema citado, de acordo com a RDC 210.
Assinale a opção abaixo que NÃO correlaciona os graus de cada área de produção com os tipos de produtos estéreis correspondentes.
Considere as afirmativas em relação à produção da forma farmacêutica supositórios.
( ) A base deve ser estável durante a estocagem, e derreter na presença dos fluidos retais.
( ) É importante conhecer o coeficiente de partição óleo/água da base em relação às drogas, para avaliar o poder de absorção através da mucosa retal.
( ) A manteiga de cacau é uma base para fabricação de supositórios que, apesar de possuir forma polifmórfica, não altera a sua capacidade de fusão na mucosa retal. ( ) A gelatina glicerinada é utilizada como veículo para supositórios vaginais, por possuír compatibilidade com a mucosa vaginal e possuir uma consistência adequada para a sua aplicação.
Marque a sequência correta de afirmativas verdadeiras (V) e falsas (F), nas opções abaixo.
Analise as afirmativas abaixo e marque a única INCORRETA.
Observe a reação de degradação de um Princípio Ativo bastante utilizado no processo de fabricação de comprimidos, o ácido acetilsalíclico (AAS).
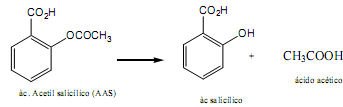
Pode-se afirmar que a reação acima de degradação foi de