Questões de Concurso
Sobre calor latente em física
Foram encontradas 22 questões
Toda matéria é constituída de partículas, átomos e moléculas, em constante agitação. Quanto mais quente estiver um corpo, maior o movimento, a agitação, a vibração e a energia cinética de cada uma de suas partículas. A temperatura é uma grandeza física que permite avaliar a agitação média dessas partículas.
Fernando Gewandsnadjer. Ciências − matéria e energia, 9. São Paulo: Editora ática, 2016.
(BBC News Brasil. Roupa preta realmente esquenta mais no calor?, 2017. Disponível em: https://www.bbc.com/portuguese/geral40448655 )
Assinale a alternativa que preencha corretamente o nome do fenômeno natural apresentado no texto.
Com base nesse caso hipotético, assinale a alternativa que apresenta a fração dessa porção de gelo que irá derreter.
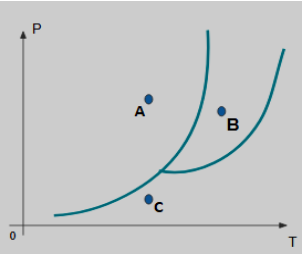
Que mudanças de fase ocorrem quando a substância passa do estado A para o estado C e em seguida do estado C para o estado B?
A figura abaixo representa mudanças de estados físicos da matéria:
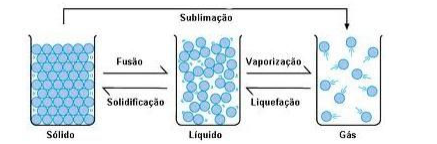
Sobre a matéria e suas transformações, é CORRETO afirmar que:
A tabela abaixo informa os calores específicos de algumas substâncias.
Substância Calor específico (cal/g.°C)
Areia 0,12
Vidro 0,20
Aluminio 0,22
Água 1,0
Gelo 0,50
Vapor 0,48
Mercúrio 0,03
Prata 0,05
Ferro 0,11
A partir dos dados da tabela, assinale V para a afirmativa verdadeira e F para a falsa.
( ) A água, por ter um calor específico muito elevado, é um excelente elemento termo-regulador. A ausência de água nos desertos, por exemplo, permite que ocorram enormes diferenças entre a máxima e a mínima temperaturas em um mesmo dia.
( ) Para resfriar uma peça aquecida, é comum mergulhá-la em água. Seria mais eficiente mergulhá-la em mercúrio. Só não se faz isso porque, além de o mercúrio ser muito caro, seus vapores são extremamente tóxicos.
( ) Se duas amostras de massas iguais, uma de água e outra de areia forem expostas ao Sol, de modo que recebam a mesma quantidade de calor durante o mesmo tempo e a temperatura da amostra de água aumentar 3°C, a temperatura de areia aumentará 25°C.
As afirmativas são, respectivamente,
“Conforme demonstrou o químico escocês Joseph Black (1728 - 1799) em uma de suas célebres experiências (…) em 1757, ao misturar água a 78ºC com a mesma quantidade de gelo a 0ºC, observou que o gelo se fundiu todo mantendo-se, no entanto, em 0ºC.”
“A crônica do Calor: Calorimetria”, J.M.F. Bassalo, Revista Brasileira do Ensino de Física, Vol. 14 (1), 1992, p. 29.
Em experimentos de calorimetria são comuns desvios sensíveis entre valores observados e calculados com modelos ideais. Considerando o experimento de Black narrado por Bassalo segundo o modelo ideal em que há apenas trocas de calor entre a água, calor específico de 1 cal/gºC, e o gelo, calor latente de fusão de 80 cal/g, assinale a alternativa que representaria a expectativa teórica ideal.
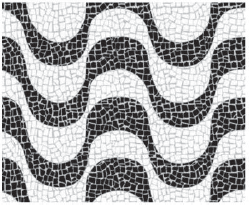
As pedras pretas ficam mais quentes do que as brancas porque
Dados: Calor específico do gelo = 0,50 cal/g °C Calor específico da água = 1,0 cal/g °C Calor específico do vapor de água = 0,50 cal/g °C Calor latente de fusão do gelo = 80 cal/g Calor latente de vaporização da água = 540 cal/g
Em um processamento, 200 kg de água a 30 °C são aquecidos até a obtenção de 200 kg de vapor d’água a 110 °C. A quantidade de calor, em J, necessária para esse processamento corresponde aproximadamente a
Dado
Calor latente de vaporização da água: 2,3 x 106 J kg-1
Calor específico da água: 4,2 x 103 J kg-1 K-1
Calor específico do vapor d’água:
2,0 x 103
J kg-1
K-1
Isso acontece porque
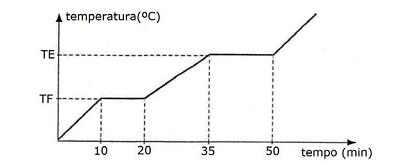
Sobre esse gráfico das mudanças de estado da substância x, foram feitas as seguintes afirmativas:
I. Aos 10 minutos marca-se o início da fusão dessa substância.
II. Durante as mudanças de estado (fusão e ebulição), a temperatura permanece constante, por se tratar de uma substância pura.
III. O gráfico é, sem dúvida, sobre mudança de estado de uma substância pura, pois apresenta dois patamares.
IV. A temperatura ideal de ebulição desta substância é registrada apenas aos 50 minutos.
V. Aos 30 minutos, essa substância está no estado líquido.
VI. Aos 15 minutos, essa substância apresenta-se sob os estados: sólido e líquido.
VII. Aos 55 minutos essa substância está no estado de vapor.
VIII. O gráfico pode ser sobre mudança de estado de uma substância pura, pois não apresenta patamares, mas sim, diferentes variações de temperatura em diferentes intervalos de tempo.
Da análise das afirmativas, conclui-se:
Ponto de fusão é a temperatura na qual ocorre a passagem do estado sólido para o líquido, a determinada pressão.
PORQUE
O ponto de fusão não depende da quantidade de material e, sim, do tipo, sendo uma grandeza extensiva.
A esse respeito, conclui-se que