Questões de Concurso
Sobre física térmica - termologia em física
Foram encontradas 1.088 questões
O piso utilizado na câmara escura deve ser anticorrosivo e antiderrapante, e as paredes devem ser revestidas com material resistente à ação das substâncias químicas ali utilizadas.
II. A variação do comprimento depende do material de que é constituída a barra.
III. A variação do comprimento é diretamente proporcional à variação de temperatura.
IV. A variação do comprimento é diretamente proporcional ao comprimento inicial da barra.
Assinale a alternativa que indica todas as afirmativas verdadeiras.
A tabela abaixo informa os calores específicos de algumas substâncias.
Substância Calor específico (cal/g.°C)
Areia 0,12
Vidro 0,20
Aluminio 0,22
Água 1,0
Gelo 0,50
Vapor 0,48
Mercúrio 0,03
Prata 0,05
Ferro 0,11
A partir dos dados da tabela, assinale V para a afirmativa verdadeira e F para a falsa.
( ) A água, por ter um calor específico muito elevado, é um excelente elemento termo-regulador. A ausência de água nos desertos, por exemplo, permite que ocorram enormes diferenças entre a máxima e a mínima temperaturas em um mesmo dia.
( ) Para resfriar uma peça aquecida, é comum mergulhá-la em água. Seria mais eficiente mergulhá-la em mercúrio. Só não se faz isso porque, além de o mercúrio ser muito caro, seus vapores são extremamente tóxicos.
( ) Se duas amostras de massas iguais, uma de água e outra de areia forem expostas ao Sol, de modo que recebam a mesma quantidade de calor durante o mesmo tempo e a temperatura da amostra de água aumentar 3°C, a temperatura de areia aumentará 25°C.
As afirmativas são, respectivamente,
Quando a temperatura ambiente torna-se suficientemente baixa, as águas dos lagos, dos rios e dos oceanos congelam a partir da superfície. Assim, abaixo dessa camada superficial de gelo, a água permanece na fase líquida. Isso permitiu, em uma era glacial primitiva, a sobrevivência, no seio dessa água líquida, de seres unicelulares que, evolutivamente, originaram todas as espécies vivas.
São listadas, a seguir, três propriedades da água:
( ) tem uma dilatação anômala entre 0 °C e 4°C;
( ) tem um calor específico muito elevado;
( ) é má condutora de calor.
Assinale R para a propriedade que é relevante para explicar esse comportamento da substância água descrito acima e N para a propriedade que não é relevante.
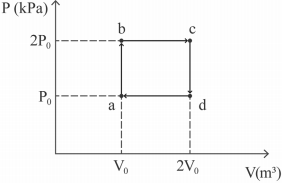
A figura precedente mostra um ciclo reversível de 1,0 mol
de um gás monoatômico ideal. Supondo que P0 = 100 kPa
e V0 = 0,02 m³, o valor da eficiência desse ciclo será
Julgue os itens a seguir,relacionados à termodinâmica.
I A lei zero da termodinâmica estabelece que, se dois corpos A e B estão, separadamente, em térmico com um terceiro corpo C, então A e B estão em equilíbrio térmico entre si.
II Em se tratando de uma substância pura, são necessárias duas variáveis independentes para a determinação de todas as outras variáveis de estado.
III Em um gás monoatômico ideal, a energia interna é função apenas da temperatura do gás, ou seja, não depende de outras variáveis.
IV Em uma expansão isotémica, a variação de entropia é nula.
Estão certos apenas os itens
“Conforme demonstrou o químico escocês Joseph Black (1728 - 1799) em uma de suas célebres experiências (…) em 1757, ao misturar água a 78ºC com a mesma quantidade de gelo a 0ºC, observou que o gelo se fundiu todo mantendo-se, no entanto, em 0ºC.”
“A crônica do Calor: Calorimetria”, J.M.F. Bassalo, Revista Brasileira do Ensino de Física, Vol. 14 (1), 1992, p. 29.
Em experimentos de calorimetria são comuns desvios sensíveis entre valores observados e calculados com modelos ideais. Considerando o experimento de Black narrado por Bassalo segundo o modelo ideal em que há apenas trocas de calor entre a água, calor específico de 1 cal/gºC, e o gelo, calor latente de fusão de 80 cal/g, assinale a alternativa que representaria a expectativa teórica ideal.
[Conforme demonstrado pelos experimentos contidos neste trabalho:] A quantidade de calor capaz de aumentar a temperatura de uma libra de água [0,45kg] de 1ºF necessita para sua realização uma quantidade de energia mecânica correspondente àquela disponível na queda de uma massa de 772 libras [350kg] a uma distância de um pé [30,5cm].
Adaptado de James Prescott Joule Philosophical Transactions of the Royal Society of London Vol. 140 (1850), pp. 61-82.
Por definição a unidade caloria que foi inventada para medir calor tinha como referência o calor específico da água, c =1 cal/gºC. Ao passo que joule é a unidade derivada para energia na mecânica. A equivalência entre duas quantidades físicas só pode se dar se elas puderem ser convertidas uma na outra. Dados: pontos do gelo e do vapor na escala Farenheit, respectivamente: 32ºF e 212ºF, considere g=10m/s² . A conclusão de Joule leva aproximadamente a:
Analise as afirmativas a seguir.
I. Os ácidos são um dos quatro grupos de substâncias, cada qual com propriedades próprias, bem definidas e denominadas propriedades funcionais.
II. Propriedades físicas como, por exemplo, a temperatura de fusão são, também, uma propriedade funcional, e são apresentadas por grupos de substâncias.
III. Propriedades químicas como, por exemplo, a combustão do carvão são, também, uma propriedade específica que são apresentadas por cada substância pura individualmente.
IV. A massa, a impenetrabilidade e o brilho são propriedades apresentadas por todas as substâncias e conhecidas por propriedades gerais da matéria.
Estão INCORRETAS apenas as afirmativas
Os estados da matéria representam a forma em que um elemento se encontra a uma determinada temperatura e pressão. São cinco os estados físicos da matéria aceitos pelos cientistas atuais: o sólido, o líquido, o gasoso, o plasma e o condensado de Bose-Einstein. Sobre o estado sólido, analise as afirmativas abaixo e assinale a alternativa correta.
I. Os sólidos conservam sua forma, porém não conservam seu volume ao longo do tempo – vide o caso do gelo.
II. A diferença entre os estados físicos está na forma de organização das moléculas, quanto maior a agitação molecular, mais organizada é a estrutura cristalina.
III. Sólidos mantém suas partículas constituintes dispostas em um arranjo interno regularmente ordenado.
IV. O arranjo interno das moléculas ou átomos é chamado retículo cristalino ou estrutura cristalina.
V. A passagem do estado sólido para o estado líquido chama-se fusão e a passagem do estado sólido para o gasoso chama-se sublimação.
Assinale a alternativa que contém as afirmações verdadeiras: