Questões de Concurso
Comentadas sobre grandezas: massa, volume, mol, massa molar, constante de avogadro e estequiometria. em química
Foram encontradas 766 questões
2NaN3(s) → 2 Na(s)+ 3N2(g) 10 Na(s) + 2 KNO3(s) → K2O(s) + 5 Na2O(s) + N2(g)
Dados:
Na (23 g.mol-1 ), N (14 g.mol-1 ), K (39 g.mol-1 ) e O (16 g.mol-1 ) Volume molar nas condições normais de temperatura e pressão (CNTP)=22,4L
Quando 100g de azida de sódio e 0,8 mol de nitrato de potássio são misturados, o volume de gás produzido na CNTP, em litros, para inflar o “airbag” será
(Considere as massas molares em g/mol: Al = 27 e O = 16)
2 KCl (aq) + Pb(NO3)2 (aq) ➞ PbCl2 (s) + 2 KNO3
(Considere as seguintes massas molares em g/mol: K = 39, Cl = 35,5, Pb = 207, N = 14 e O = 16)
FeS2(s)+O2(g)⟶Fe2O3(s)+SO2(g)
Sabendo que a massa molar da pirita (FeS₂) é 120 g/mol, a massa de SO₂ produzida a partir da queima total do minério utilizado é de
Dados Na = 23 g/mol; O = 16 g/mol; H = 1 g/mol.
Dados: log 2 = 0,30
I. A molaridade desta solução é 0,01 mol/L.
II. O pH desta solução é 11,7.
III. 200 mL de uma solução de ácido clorídrico (HCl) 0,01 mol/L são necessários para neutralizar 100 mL desta solução de Ca(OH)2.
Está(ão) CORRETA(S)
Considerando que não há perda de massa no sistema e que a coluna opera em regime estacionário, qual é a fração aproximada de recuperação de A na corrente do destilado?
Dados: MM (Ca) = 40,07 g/mol MM (CaO) = 56,07 g/mol
Considerando os cálculos estequiométricos e os assuntos correlatos, julgue o item a seguir.
A reação entre permanganato de potássio e ácido clorídrico em solução aquosa, dando como produtos cloreto de potássio, cloreto de manganês(II), cloro gasoso e água, pode ser representada pela equação química balanceada apresentada a seguir.
2 KMnO4 (aq) + 16 HCl (aq) → 2 KCl (aq) + 2 MnCl2 (aq)
+ 5 Cl2 (g) + 8 H2O (l)
Considerando os cálculos estequiométricos e os assuntos correlatos, julgue o item a seguir.
Conforme a equação genérica a seguir, a soma dos valores representados pelas letras minúsculas a + b deve ser igual à soma dos valores representados pelas letras minúsculas c + d:
a A (g) + b B (g) → c C (g) + d D (g)
Considerando os cálculos estequiométricos e os assuntos correlatos, julgue o item a seguir.
Em uma reação química, os coeficientes
estequiométricos mostram que os átomos podem ser
criados ou destruídos em uma reação balanceada.
1. pesou o objeto em uma balança analítica observando uma massa igual a 57,8499 g;
2. colocou 40,0mL de água em uma proveta;
3. mergulhou o objeto na água e observou a nova marcação do volume igual a 48,1mL;
4. pesquisou as densidades desses metais na literatura especializada:
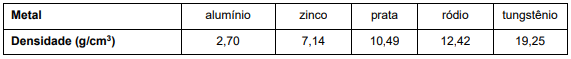
A partir desses dados, é possível concluir que o objeto é constituído de:
A química desempenha um papel crucial no processo de reciclagem, pois permite a transformação de materiais descartados em novos produtos, contribuindo para a redução do desperdício e a preservação dos recursos naturais. Um exemplo notável é o alumínio, cuja reciclagem é economicamente viável e energeticamente eficiente devido à sua capacidade de ser fundido e remodelado repetidamente sem perder suas propriedades físicas. Além disso, a síntese do alúmen (KAl(SO4)2.12H2O) a partir do alumínio reciclado destaca-se como um processo químico relevante na reciclagem desse metal. A reação dessa síntese pode ser observada abaixo e já está estequiometricamente balanceada.
𝐴𝑙(𝑠) + 𝐾𝑂𝐻(𝑎𝑞) + 2𝐻2𝑆𝑂4(𝑎𝑞) + 11𝐻2𝑂 → 𝐾𝐴𝑙(𝑆𝑂4)2 . 12𝐻2𝑂(𝑠) + 3⁄ 2 𝐻2(𝑔)
Suponha que a preparação do alúmen partiu de 2 g de lata de alumínio. Ao final do experimento obteve-se uma massa de 10 g de alúmen seco.
Dados: H: 1 u, O: 16 u, S: 32 u; Al: 27 u; K: 39 u. A massa molar do alúmen é de 474 g/mol.
Assinale a alternativa CORRETA em que indica o rendimento mássico teórico do alúmen e seu rendimento percentual experimental, respectivamente.