Questões de Concurso
Comentadas sobre interações atômicas: geometria molecular, polaridade da ligação e da molécula, forças intermoleculares e número de oxidação. em química
Foram encontradas 115 questões
A iodometria é um método analítico indireto de titulação de iodo. Dentre os reagentes envolvidos, temos o triiodeto, que se forma segundo a reação em equilíbrio representada a seguir:
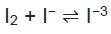
Ao analisar a equação dada e as propriedades químicas das espécies participantes, é correto afirmar
que
O cloreto de tionila, composto inorgânico com a fórmula SOC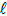 2 ,
é um reagente químico muito usado em reações de cloração. É
um líquido incolor, destilável à temperatura ambiente que
decompõe-se acima de 140ºC. É um composto de S(IV) formado
por ligações químicas de natureza covalente.
2 ,
é um reagente químico muito usado em reações de cloração. É
um líquido incolor, destilável à temperatura ambiente que
decompõe-se acima de 140ºC. É um composto de S(IV) formado
por ligações químicas de natureza covalente.
Assinale a opção que melhor representa a estrutura geométrica
de equilíbrio do cloreto de tionila.
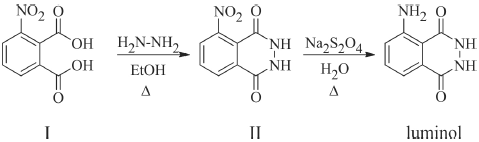
O luminol, empregado na prática forense para identificação de
vestígios de tecido sanguíneo, pode ser preparado a partir dos
compostos I e II, conforme a rota sintética representada na figura
precedente. A respeito das estruturas químicas apresentadas nessa
figura e das propriedades físicas e químicas de suas moléculas,
assinale a opção correta.
Considere as seguintes entalpias padrões, 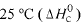
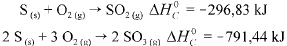
Com base nessas informações, julgue o item que se segue.
A molécula de SO2 é apoiar, enquanto a de SO3 é polar
Um químico desejava preparar 500 mL de uma solução de hidróxido de amônio (NH4OH) 0,10 mol/L pela diluição de uma solução estoque de NH4OH que, segundo o rótulo do frasco, apresenta concentração 30% em m assa e densidade 0,895 g/mL. Com base nesses dados, o químico realizou o cálculo do volume da solução estoque a ser em pregado e preparou a solução. Como a amônia é um a substância altamente volátil, o químico julgou conveniente aferir a concentração da solução resultante realizando a titulação de 20,0 mL dessa solução com uma solução padrão de HC1 0,090 mol/L.
Considerando que, a 25 °C, a constante de basicidade do NH4OH é igual a 1,8 x 10 5 e a constante de autoprotólise da água, definida como o produto das atividades dos íons hidróxido e hidrônio, é igual a 1,0 x 10-14 , e atribuindo comportamento ideal para todas as soluções envolvidas, julgue o item seguinte, tendo o texto apresentado como referência.
A polaridade da ligação H— X, em que X corresponde a um
halogênio, é maior no HC1 que no HBr.
Um químico desejava preparar 500 mL de uma solução de hidróxido de amônio (NH4OH) 0,10 mol/L pela diluição de uma solução estoque de NH4OH que, segundo o rótulo do frasco, apresenta concentração 30% em m assa e densidade 0,895 g/mL. Com base nesses dados, o químico realizou o cálculo do volume da solução estoque a ser em pregado e preparou a solução. Como a amônia é um a substância altamente volátil, o químico julgou conveniente aferir a concentração da solução resultante realizando a titulação de 20,0 mL dessa solução com uma solução padrão de HC1 0,090 mol/L.
Considerando que, a 25 °C, a constante de basicidade do NH4OH é igual a 1,8 x 10 5 e a constante de autoprotólise da água, definida como o produto das atividades dos íons hidróxido e hidrônio, é igual a 1,0 x 10-14 , e atribuindo comportamento ideal para todas as soluções envolvidas, julgue o item seguinte, tendo o texto apresentado como referência.
A molécula de NH3 é apoiar e apresenta geometria trigonal
plana.
2KNO3(s) + S(s) + 3C(s) -> K2S(s) + N2(g) + 3CO2(g).
Com base nessas informações, julgue o item seguinte.
Apesar de apresentarem arranjos eletrônicos diferentes, as moléculas dos compostos CO2 e SO2 possuem geometrias moleculares idênticas e polaridades similares.