Questões de Concurso
Comentadas sobre interações atômicas: ligações iônicas, ligações covalentes e ligações metálicas. ligas metálicas. em química
Foram encontradas 293 questões
I. As ligações intramoleculares (iônicas, covalentes e metálicas) são mais fortes que as ligações intermoleculares e determinam a estabilidade estrutural das moléculas.
II. As forças intermoleculares, como as forças dipolo-dipolo, forças de London e ligações de hidrogênio, influenciam diretamente propriedades como ponto de fusão e ebulição das substâncias.
III. Substâncias que possuem ligações de hidrogênio, como a água e o etanol, apresentam pontos de ebulição mais elevados do que aquelas que possuem apenas forças de London.
Coluna 1
1. Covalente.
2. Iônica.
3. Metálica.
Coluna 2
( ) Ligação intermediária, conduz eletricidade, insolúvel em água, normalmente no estado sólido (exceto o Mercúrio).
( ) Ligação forte, não conduz eletricidade, pode ou não ser solúvel em água, quando misturado com água não libera íons nem conduz eletricidade.
( ) Ligação intermediária, não conduz eletricidade, pode ou não ser solúvel em água, quando misturado com água libera íons e conduz eletricidade.
A ordem correta de preenchimento dos parênteses, de cima para baixo, é:
Com base na fórmula química e na classificação das substâncias, assinale, das alternativas abaixo, a que apresenta corretamente a substância e sua classificação química.
( ) Quando o núcleo de urânio-238 perde uma partícula alfa, o fragmento restante tem número atômico 90 e número de massa 234.
( ) Para transformar urânio-238 em rádio-226 foram emitidas 3 partículas beta (β).
( ) A radiação gama consiste em fótons de alta energia; muda a massa e o número atômico de um núcleo.
( ) Quando o rádio-226 sofre decaimento alfa o produto formado é 86Rn222.
A sequência está correta em
Considere as alternativas abaixo e aponte a que está CORRETA sobre o conceito acima.
Em relação aos dois tipos de ligações químicas A e B, representados na figura a seguir, e as suas características, assinale a alternativa CORRETA.
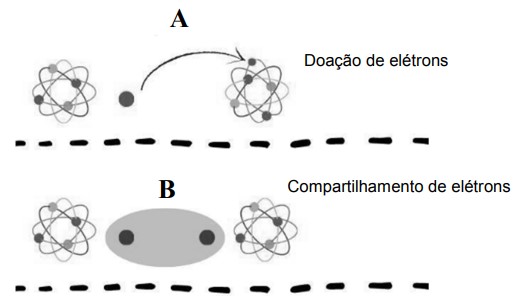
Disponível em: https://brainly.com.br/tarefa/54395932. Acesso em: 10 out. 2024.
Considerando os conceitos relacionados à ligação covalente e o disposto na imagem, é correto afirmar que:
Sobre os conceitos de ligações covalentes e geometria molecular, assinale, a seguir, uma molécula que evidencia a configuração eletrônica espacial descrita.
Átomos se combinam para formar moléculas e compostos iônicos, compartilhando ou transferindo elétrons de valência. A partir deste contexto, analise as proposições a seguir.
I- Nos organismos, as ligações químicas mais fortes são majoritariamente covalentes, que unem os átomos para formar as moléculas da célula.
II- Ligações covalentes são aquelas em que há o compartilhamento, por dois átomos, de um par de elétrons de valência, como no caso da molécula de hidrogênio.
III- Ligações iônicas são aquelas em cátions e ânions se atraem, como no caso do cloreto de sódio.
É CORRETO o que se afirma em:
Em relação às ligações químicas, julgue o item a seguir.
A ligação química entre os metais é o resultado do
baixo empacotamento observado entre os átomos
que formam a estrutura metálica, o que resulta na
característica de baixa condutividade elétrica.
Em relação às ligações químicas, julgue o item a seguir.
Alguns elementos apresentam a tendência de perder
elétrons e cedem seus elétrons com outro elemento
não metálico, formando uma ligação covalente.
Em relação às ligações químicas, julgue o item a seguir.
A ligação iônica é uma força de atração que mantém
cátions e ânions unidos, formando os compostos
iônicos, como o cloreto de sódio (NaCl).
LOPES, S. Viver Ciências 6. São Paulo: Moderna, 2021. (adaptado).
Se uma pequena barra metálica for feita de ouro 20 quilates e tiver a massa de 60 gramas, quantas gramas correspondem ao ouro?
Na ligação metálica, ocorre a ocupação do espaço de modo mais eficiente possível na estrutura metálica, com os elétrons da camada de valência responsáveis pela condução da energia elétrica e térmica.
A ligação covalente é formada por átomos que se ligam compartilhando pares de elétrons, que passam a pertencer, ao mesmo tempo, a ambos os átomos.
Os compostos iônicos são formados pela ligação entre os elementos não metais, que formam cátions e ânions, tendo o oxigênio como principal representante.