Questões de Concurso Comentadas sobre química
Foram encontradas 7.275 questões
Analise as afirmativas abaixo em relação ao assunto.
1. Em todas as amostras coletadas para análises bacteriológicas, deve ser efetuada medição de cor, turbidez e residual de desinfetante.
2. As coletas de amostras para análise dos parâmetros de agrotóxicos deverão considerar a avaliação dos seus usos na bacia hidrográfica do manancial de contribuição, bem como a sazonalidade das culturas.
3. A amostragem deve obedecer a uma distribuição uniforme das coletas ao longo do período de um ano.
Assinale a alternativa que indica todas as afirmativas corretas.
Assinale a alternativa que possui a sequência correta dos processos utilizados em uma Estação de Tratamento de Água (ETA), tipo convencional, que engloba todas as fases necessárias para um tratamento completo:
A figura a seguir apresenta o cromatograma de uma mistura de hidrocarbonetos:
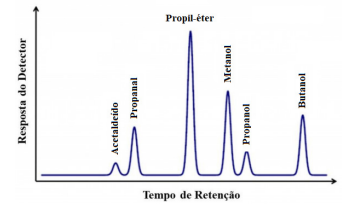
Com base nos picos obtidos para cada substância, é
correto afirmar:
O esquema a seguir apresenta o processo de obtenção de óleo rico em canabinoides utilizando solvente como meio extrator.
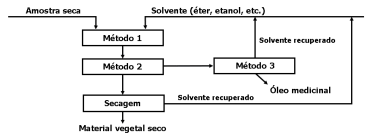
Os métodos 1, 2 e 3 correspondem, respectivamente, aos processos de separação denominados:
( ) Deve-se adicionar lentamente a água no ácido e nunca ao contrário, a fim de evitar uma reação violenta.
( ) A adição de ácido sobre a água faz a temperatura aumentar rapidamente, podendo haver uma pequena explosão, espirrando ácido na pessoa e/ou podendo até mesmo quebrar o recipiente que contém a solução.
( ) Devem-se utilizar luvas, óculos de proteção ou proteção facial e jaleco, sendo dispensado o uso de capela se tiver próximo a um lava-olhos e a um chuveiro de segurança.
Assinale a alternativa que indica a sequência correta, de cima para baixo.
Qual a concentração da solução de hidróxido de potássio para neutralizar completamente o ácido?
Considere a massa molar do HNO3 igual a 63 g/mol e a massa molar do KOH igual a 56 g/mol.
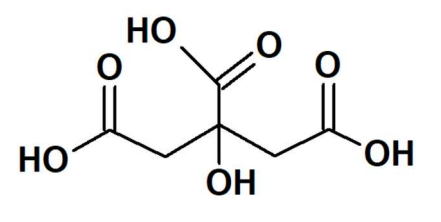
Observe a fórmula estrutural do glifosato a seguir:
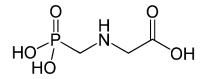
Com base na sua estrutura, é correto afirmar que o glifosato:
Uma das substâncias frequentemente encontradas em águas e esgotos é o norfloxacino, um antibiótico da classe das fluoroquinolonas de segunda geração que é usado para infecções do trato urinário representado pela seguinte fórmula estrutural:
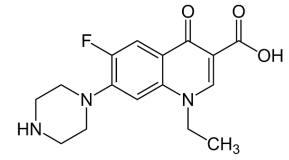
A fórmula molecular do norfloxacino é:
CaCO3 + H3PO4 ➜ CaHPO4 + CO2 + H2O
Considere que se disponha de 100 kg de calcário (com teor de 90% em CaCO3) para reagir com ácido fosfórico (H3PO4) e formar fosfato bicálcico.
Qual a quantidade, em massa, de sal formado?
Associe as substâncias inorgânicas da coluna 1 com a respectiva aplicação listada na coluna 2.
Coluna 1 Substâncias inorgânicas
1. (NH4)2SO4
2. Na2CO3
3. KMnO4
4. NaHCO3
Coluna 2 Aplicações
( ) Usado como um dos componentes de extintores de incêndio (pó pressurizado).
( ) Usado no tratamento de água.
( ) É um sal utilizado como fertilizante.
( ) Antisséptico com ação antibacteriana e antifúngica.
Assinale a alternativa que indica a sequência correta,
de cima para baixo.
A solução de sulfato de cobre penta-hidratado possui 0,9988 g e a massa molar é 249,7 g/mol, já o KIO3 possui massa molar igual a 214,0 g/mol.
Qual a massa de KIO3, em gramas, necessária para que ocorra a precipitação?
A descrição acima refere-se à/ao:
Para se determinar o teor percentual massa/volume (% m/V) em um determinado limão, coletou-se 2,0 mL do sumo deste limão e titulou-se, em triplicata, através de técnica adequada, com solução padronizada de NaOH 0,110 mol L-1 na presença de indicador fenolftaleína até atingir o ponto de equivalência. Gastou-se, em média, 12,0 mL da base. Desta forma, o valor calculado para o teor % (m/V) de ácido cítrico no limão é igual a
CH3COOH(aq) ⇄ CH3COO- (aq) + H+ (aq)
Dado: pH = -log [H+]
Suponha que foi preparada, em laboratório, uma solução aquosa de ácido acético 0,2 mol L-1. O pH dessa solução possui valor aproximado de
Cu(s) + HNO3(aq) → Cu(NO3)2(aq) + NO(g) + H2O(l)
Balanceando-se a equação de oxirredução acima com algarismos inteiros, determina-se que o somatório de todos os seus coeficientes estequiométricos é igual a
Ag+ (aq) + e- (aq) → Ag(s) E° = 0,80 V Mg2+(aq) + 2e- (aq) → Mg(s) E° = -2,37 V
Determina-se que o potencial padrão da célula em volts, a 25 °C, é
Br2(aq) + HCOOH(aq) → 2Br- (aq) + 2H+ (aq) + CO2(g)
Sabendo-se que a concentração inicial do bromo é 0,120 mol L-1 e que, após 200 s, diminui para 0,060 mol L-1 , determina-se que a constante de velocidade da reação, em s-1, é igual a