Questões de Concurso Comentadas sobre química
Foram encontradas 7.275 questões
Observe o diagrama de energia a seguir.
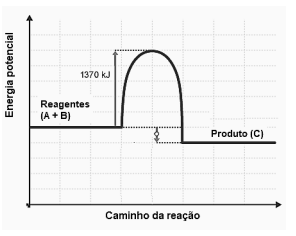
O diagrama se refere a uma reação do tipo
O SO2 é um(a)
Nessa temperatura, o uso de 20 g de permanganato de potássio para preparar 250 mL de uma solução aquosa resultará em uma solução
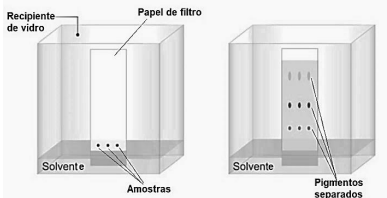
Disponível em: https://docplayer.com.br/12445935- Cromatografia-em-camada-delgada-ccd-ou-thin-layer-chromatography-tlc.html. Adaptado.
Na representação acima, de uma cromatografia em papel, a fase estacionária é(são)
O peróxido de hidrogênio, H2O2, quando em contato com um ferimento na pele, é decomposto pela enzima catalase, liberando água e gás oxigênio, conforme reação a seguir.
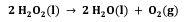
Considerando que 1,3 L de H2O2 (densidade = 1,00 g/mL) se decompõe a 40 °C e pressão de 1,0 atm, assinale a alternativa que apresenta o volume aproximado de gás oxigênio produzido.
Dados:
MM (H2O2) = 34 g/mol.
C = K (Kelvin) – 273
R = 0,082 L.atm/mol.K
Identifique as técnicas clássicas descritas abaixo, respectivamente:
I. Identificação de íons metálicos por meio da cor da chama.
II. Quantificação da concentração de uma substância por meio da adição controlada e quantificada de outra substância reativa de concentração conhecida.
III. Separação e identificação de substâncias pela diferença da temperatura de ebulição dos constituintes.
IV. O analito é convertido numa substância pouco solúvel. O precipitado é filtrado e lavado para remoção de impurezas e convertido, quando necessário, geralmente por meio de um tratamento térmico adequado, em um produto de composição química conhecida. O produto é então pesado.
Alguns procedimentos de laboratório podem parecer simples, porém para que sejam feitos de maneira correta e segura faz-se necessário ter atenção a uma série de detalhes.
Um professor orienta para que os estudantes façam
100 mL de uma solução de NaOH 0,01 mol/L.
Faça os cálculos previamente, tendo atenção na pureza do reagente.
Pese rapidamente a quantidade calculada de
hidróxido de sódio em lentilhas em um béquer,
evitando que o frasco do reagente fique aberto por
muito tempo.
Adicione em torno de 50mL de água destilada no béquer com NaOH, dissolva bem e espere esfriar. Transfira para o balão volumétrico de 100mL utilizando funil, adicione pequenas alíquotas de água destilada no béquer transferindo-as para balão através do funil de forma que o volume não seja completo.
Adicione água destilada até que o menisco fique
próximo da marca de aferição. Faça a aferição do
menisco gotejando com pipeta de Pasteur. Tampe o
balão, faça a homogeneização.
Sobre as instruções do professor, é correto afirmar, exceto:
Identifique os tipos de reações a seguir:
I. CH3-CH2-(CH3)2C-Cl + OH- → CH3-CH2-(CH3)2→C-OH + Cl-
II. CH3-CH2-(CH3)2C-OH + H2SO4 → CH3-CH=C(CH3)2 + H2O + H2SO4
III. III. CH3-CH2-CH2-Cl + OH- → CH3-CH2-CH2- OH + Cl-
IV. CH3-CH2-CH=CH2 + HBr → CH3-CH2-CH(Br)- CH3
V. HOOC-(CH2)4-COOH + H2N-(CH2)6-NH2 → nH2O + [-NH-(CH2)6-NH-CO-(CH2)4-CO-]n
As reações expostas são, respectivamente:
I. Uma amostra de um sólido orgânico de alta pureza a ser analisado para identificar as possíveis funções orgânicas presentes em sua molécula.
II. Uma amostra de um composto orgânico analisada para contribuir na elucidação da estrutura da molécula a partir dos seus fragmentos que geram respostas de razão massa-carga.
III. Determinação da concentração de uma espécie conhecida, a partir da simples relação linear entre absorção da radiação eletromagnética e concentração.
IV. Injeção de uma amostra em uma chama, provocando a excitação eletrônica dos átomos, gerando um sinal analítico através da radiação UV-Vis gerada.
As situações descritas acima estão relacionadas, respectivamente, com as técnicas de:
Um estudante misturou 200mL de solução de ácido HX de concentração 0,1mol/L com 300mL de solução do sal de sódio desse ácido (NaX) que tinha concentração de 0,2mol/L. Sabendo que a constante de ionização do ácido HX é 0,000003. Qual o valor do pH da solução formada?
Quimicamente, a cloroquina (CQ) e a hidroxicloroquina (HCQ) pertencem à classe das 4- aminoquinodinas. Elas têm estrutura central aromática comum, com um cloro na posição 7, ligada às respectivas cadeias laterais básicas. A forma molecular da cloroquina é: C18H26CIN3, com massa molar de 319,9 g/mol. Já a hidroxicloroquina tem massa molar de 335,9 g/mol.
A CQ e a HCQ são administradas como difosfato e sulfato, respectivamente, em suas formas racêmicas.
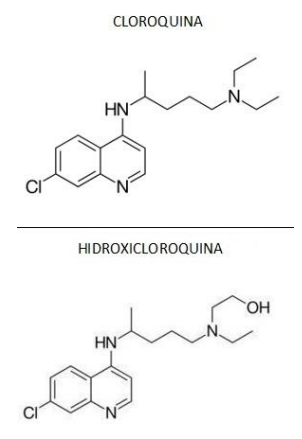
Sobre o medicamento citado acima, marque o que
for correto.
O dióxido de nitrogênio (NO₂ ) é uma molécula intermediária na produção industrial de ácido nítrico (HNO₃ ), que é muito aplicado na produção de fertilizantes. O dióxido de nitrogênio existe em equilíbrio com o tetróxido de nitrogênio (N₂O₄ ), segundo a reação:
2NO₂(g) ⇄ N₂O₄(g) ∆H = −57,23 kJ/mol
Para aumentar o rendimento do dióxido de
nitrogênio na reação, segundo o princípio de Le
Châtelier, deve-se:
(Disponível em: https://jovempan.com.br/noticias/brasil/gas-de-cozinha-atinge-maior-preco-em-2021-e-deve-ficar-ainda- mais-caro-entenda-o-reajuste-da-petrobras.html. Acessado em 28/09/2021)
Supondo que todo o GLP presente no botijão seja somente butano e está totalmente na forma líquida, e que o preço do botijão de gás seja de R$ 125,00, para uma família que teve um gasto mensal com a fatura de gás de R$ 55,77, qual a quantidade de energia que foi liberada, em quilojoules, na queima do gás butano?
A reação de combustão completa do butano (não balanceada):
C₄H₁₀(g) → CO₂ (g) + H₂O ∆H°C = 2.808 kJ/mol