Questões de Concurso Comentadas sobre química
Foram encontradas 7.317 questões
Analise as seguintes moléculas e assinale a alternativa que as classifica, de acordo com a sua função orgânica.
I. CH3OH
II. CH2CH2
III. CH3CH2OCH2CH3
Considere as seguintes reações para células eletroquímicas e assinale a alternativa correta.
1. Cu2+ + Zn0 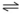 Cu0 + Zn2+ E= 1,1V
Cu0 + Zn2+ E= 1,1V
2. Cu0 + Zn 2+ 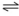 Cu2+ + Zn0 E= -1,1V
Cu2+ + Zn0 E= -1,1V
Dado: MMetilenoglicol= 62g;mol
O Ca(OH)2 é ____________, ou seja, em solução aquosa está ____________.
Referente à seguinte reação:
Mg (s) + O2 (g) MgO(s) ------------>
analise as assertivas e assinale a alternativa que aponta as corretas.
I. É uma reação de combinação.
II. A molécula de oxigênio é formada por ligação iônica.
III. A queima de 2 mol de Mg(s) resulta em 1 mol de MgO.
IV. O produto da reação é um sólido iônico.
Em relação às seguintes moléculas,assinale a alternativa INCORRETA.
1. Forças de London. 2. Ligação de hidrogênio. 3. Dipolo-dipolo.
( ) H2S ( ) NH3 ( ) I2
Foi detectada a presença de 32µg de dióxido de enxofre em 100L de ar de um recinto fechado que se encontra a 25°C (a 1 atm).
A composição em ppm (v/v) desse poluente no recinto, considerando o comportamento ideal dos gases, é aproximadamente igual a
Dados: Constante dos gases = 0,082 atm.L.mol–1 .K–1 . Massa molares (g.mol–1 ): S = 32 e O = 16
Um dos critérios que pode ser utilizado para classificar águas naturais é o de dureza, propriedade que resulta da dissolução de minerais do solo e das rochas ou do aporte de resíduos industriais.
A classificação de águas naturais, de acordo com a dureza, é expressa em função da concentração de
Os ciclos biogeoquímicos contribuem para a troca de matéria e energia entre a hidrosfera, a atmosfera e a litosfera.
O ciclo hidrológico está relacionado à distribuição da energia solar assim como as propriedades da água estão relacionadas às seguintes funções:
I. ao transporte de nutrientes no meio aquoso.
II. à alta solubilização de espécies iônicas.
III. à flutuação do gelo e à circulação vertical de nutrientes na coluna d’água.
IV. à estabilização da temperatura da biota.
A água realiza essas funções graças às seguintes propriedades:
Leia o fragmento a seguir.
"Os alquimistas do século XIV tornaram-se os primeiros a compreender a natureza dos ácidos. O único ácido conhecido pelos antigos fora o ácido acético fraco do vinagre. No século VIII, Djabir havia preparado uma solução fraca de ácido nítrico e outros alquimistas árabes descobriram que a destilação do vinagre produzia um ácido acético mais forte. Mesmo o ácido acético forte, porém, pouco tinha de corrosivo. Não parecia ser dotado de muito poder reagente.”
(STRATHERN, P. O sonho de Mendeleiev. A verdadeira história da química. 2002, Zahar, p. 57).
Com relação aos ácidos, assinale V para a afirmativa verdadeira e F para a falsa.
( ) O ácido acético pode ser classificado como forte ou fraco dependendo do valor do seu Ka, o que explica as observações obtidas pelos alquimistas.
( ) O ácido nítrico é um ácido fraco, o que corresponde ao observado experimentalmente pelos alquimistas.
( ) Tanto o ácido acético como o ácido nítrico são ácidos fortes, porém os alquimistas não tinham informações suficientes para classificá-los corretamente.
As afirmativas são, respectivamente,
Leia o fragmento a seguir.
“A análise refere-se a um trecho da transcrição de uma aula na qual um grupo de alunos vai discutir (...) sobre o fenômeno da queima de uma fita de magnésio. A atividade proposta (...) inclui a realização de cinco testes que correspondem a transformações químicas que são acompanhadas por diferentes evidências.”
(MACHADO, A. H. Aula de Química: discurso e conhecimento. Ed. UNIJUÍ, Ijuí, 3ª ed., 2014.)
Na prática citada com uma fita de magnésio, os alunos observariam as seguintes evidências de transformações químicas:
I. a liberação de energia luminosa.
II. a formação de um sólido branco.
III. a necessidade de aquecimento.
Está correto o que se afirma em
No estudo de Termoquímica, o professor propôs uma experiência para determinação do calor de combustão do álcool etílico (etanol).
O procedimento experimental e as anotações de um grupo de alunos estão apresentados a seguir:
I. preparar a lamparina colocando uma quantidade suficiente de álcool etílico para que a combustão possa ser realizada.
II. determinar a massa do sistema “álcool-lamparina” (mi) e anotar no caderno. Valor anotado mi= 180,0 g;
III. determinar a massa do erlenmeyer (me) vazio e anotar no caderno. Valor anotado me = 200,0 g;
IV. medir 100 mL de água, que correspondem a 100 g, em uma proveta e transferir para o erlenmeyer. Envolver as paredes do erlenmeyer com jornal e prender com fita crepe. Colocar em um suporte;
V. medir a temperatura da água (Ti) e anotar o valor. Valor anotado Ti = 25°C; VI. acender a lamparina e aquecer a água do erlenmeyer, durante 5 minutos. Após esse tempo, apagar a lamparina e medir a temperatura da água (Tf) e anotar o valor. Valor anotado Tf = 40°C;
VII. Medir, após algum tempo, a massa do sistema “álcool-lamparina”(mf) após a combustão. Valor anotado mf = 160,0 g.
Utilizando os dados anotados e a constante 1,0 cal.g–1 .°C –1 como calor específico da água e a constante 0,2 cal.g–1 .°C –1 como calor específico do vidro, os alunos devem chegar a um valor para o calor de combustão do álcool, em cal.g–1 , de
No estudo dos modelos atômicos, a hipótese atômica de John Dalton (1766-1844) é trazida para sala de aula dando base à discussão sobre a constituição da matéria.
Para o desenvolvimento do trabalho sobre o modelo de Dalton é importante a discussão sobre