Questões de Concurso Comentadas sobre química
Foram encontradas 7.319 questões
2SO3(g)
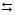 2SO2(g) + O2(g).
2SO2(g) + O2(g).
Inicialmente a pressão parcial do trióxido de enxofre era de 1,6 bar. Ao atingir o equilíbrio foi constatada uma porcentagem de decomposição de 60%.
Se a esse sistema em equilíbrio for adicionado 1 mmol de dióxido de enxofre, mantendo-se constante as condições anteriores, quando o novo equilíbrio for atingido,
Assinale a opção que indica o par que pode ser utilizado para o preparo de um tampão básico.
Com relação a esta norma, analise as afirmativas a seguir, assinalando V para as verdadeiras e F para as falsas.
( ) O laboratório deve manter registro de reclamações de clientes, das investigações e ações corretivas implementadas. ( ) O laboratório deve assegurar que condições físicas e ambientais não invalidem os resultados. ( ) O laboratório deve ter e aplicar procedimento para estimar a incerteza da medição de todas as calibrações.
Segundo a ordem apresentada, as afirmativas são, respectivamente,
Dados: massas molares em g.mol-1 : H = 1; O = 16; Na = 23.
Considere um tubo selado contendo inicialmente N2O4 com pressão parcial de 0,45 atm. e temperatura constante. Após o equilíbrio ser atingido, a pressão parcial determinada para o N2O4 foi de 0,08 atm.
Com base nesses dados experimentais, o valor aproximado da constante de equilíbrio em função das pressões parciais dos gases envolvidos, é de
Responsável pelo abastecimento de 12 milhões de pessoas na Região Metropolitana do Rio (80% da população), o Rio Paraíba do Sul está na iminência de uma catástrofe em Volta Redonda, no Sul Fluminense. O alerta consta na denúncia 1518/18, aceita pelo Ministério Público Federal, que abriu inquérito para apurar responsabilidades (...) A ação adverte para o risco de deslizamento de uma pilha gigante, sem contenção, de escória. Adaptado de https://odia.ig.com.br/rio-de-janeiro/2018 Acesso em 18/06/2018
A pilha de escória contém areia, cal virgem, enxofre e metais tóxicos como manganês, zinco, cádmio, crômio, níquel e chumbo e corre o risco de escorregar com a ação das chuvas e contaminar o rio Paraíba do Sul e os lençóis freáticos.
Assinale a opção que indica o problema ambiental que esta contaminação pode causar ao ambiente aquático.
Um pesquisador reagiu 146g de ácido clorídrico (HCℓ) com 116g de hidróxido de magnésio [Mg(OH)2], segundo a reação química abaixo:
2 HCℓ + Mg(OH)2 → MgCℓ2 + 2 H2O
Sabendo que foi produzido 72g de água (H2O), a quantidade formada de cloreto de magnésio
(MgCℓ2) foi de
“O chumbo é o segundo metal pesado mais perigoso, ao lado do mercúrio, do arsênio e do cádmio. Ele causa asma, problemas gástricos, retardamento mental, entre outros”.
O chumbo (Z=82), elemento de grande utilidade, está localizado na tabela periódica
A fim de testar as propriedades da água, Breno a aqueceu em uma panela e, antes de atingir seu ponto de ebulição, retirou a panela do fogo. Em seguida, ele recolheu parte dessa água com uma seringa, tapou a ponta dela e puxou o êmbolo. O que Breno observou, na sequência, foi que a água, dentro da seringa, entrou em ebulição a uma temperatura abaixo de 100 ºC.
A água entrou em ebulição com o deslocamento do êmbolo, pois este deslocamento
A imagem abaixo representa o modelo cinético molecular dos diferentes estados de agregação das moléculas da água.
De acordo com esse modelo, no estado físico sólido, as moléculas estão
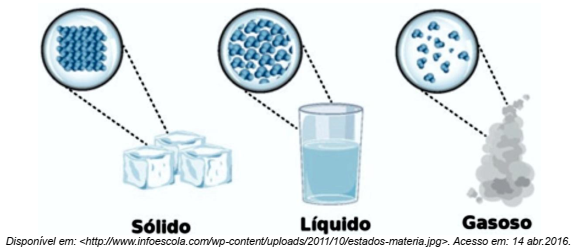
O teste de chamas, utilizado para a detecção qualitativa de alguns cátions metálicos, é possível porque o comprimento de onda da luz visível emitida por cada átomo/íon é percebido como cor. Observe a tabela com os comprimentos de onda no vácuo referentes ao espectro da luz visível.
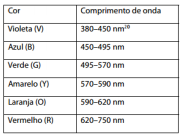
Em um ensaio de chama, para evitar confusões visuais das cores, a detecção foi realizada com auxílio de um
Colorímetro, que apresentou, para as amostras aquosas A, B e C, os comprimentos de onda 425 nm, 540 nm e 580 nm,
respectivamente. É correto afirmar que as amostras, nesta ordem, contêm cátions dos metais:
Determine o pH aproximado de uma solução tampão preparada pela adição de 14,5 g de bicarbonato de sódio e 9 g de carbonato de sódio em água suficiente para completar 500 mL de solução.
(Dados: pKa do ácido é 10,32 ; log 2 = 0,3 ; log1/2 = ‒0,3.)
A velocidade de desintegração radioativa de um radioisótopo é de primeira ordem em relação ao número de núcleos radioativos. Uma amostra contendo 5 g do 222Rn sofreu desintegração radioativa durante 6,6 dias e teve sua massa reduzida para 1,5 g. Calcule o tempo de meia‐vida, aproximadamente, em dias, desse radioisótopo.
(Dado: ln 0,30 = –1,2.)
Uma indústria metalúrgica, para analisar o teor de ferro em uma de suas peças, procedeu da seguinte forma: Pesou uma amostra de 0,6 g desta peça, converteu todo o ferro presente em íons Fe2+(aq) e titulou com uma solução de permanganato de potássio de concentração 0,01 mol.L–1, consumindo 22 mL dessa solução.
Equação iônica: MnO4–(aq) + Fe2+(aq) + H+(aq) → Mn2+(aq) + Fe3+(aq) + H2O(l)
Qual o teor de ferro, aproximadamente, em % massa, presente na peça analisada?