Questões de Concurso Comentadas sobre química
Foram encontradas 7.319 questões
56,0 g de nitrogênio gasoso foram inseridos em um pneu, a 25 °C. Considerando que a capacidade do pneu é de 10,0 litros, a pressão atingida pelo gás nesse pneu, em atmosferas, a essa temperatura, foi de, aproximadamente,
Dado:
Constante universal dos gases = 0,082 atm.L.mol−1 . K−1
O modelo para o átomo proposto por Thomson está representado abaixo.
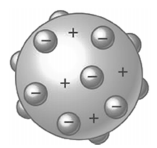
(http://www.explicatorium.com/images/modelo-Thomson.jpg. Acesso em 03/01/2016)
Com esse modelo, Thomson interpretou
Atenção: Considere as semi-reações de redução abaixo para responder à questão.
NO-3 + 4H+ + 3e- → NO + 2H2O; E0 = +0,96 V
Cu2+ + 2e− → Cu; E0 = +0,34 V
Atenção: Considere a equação de decomposição da nitroglicerina abaixo para responder à questão.
4C3H5N3O9 (ℓ) → 6N2 (g) + 12CO2 (g) + 10H2O (g) + O2 (g) + 6 161 kJ
Nas CATP, o volume ocupado pelo N2(g), em litros, quando reage 1 mol de nitroglicerina é igual a
Dado:
Volume molar de qualquer gás, nas CATP = 25,0 L
Atenção: Considere a equação de decomposição da nitroglicerina abaixo para responder à questão.
4C3H5N3O9 (ℓ) → 6N2 (g) + 12CO2 (g) + 10H2O (g) + O2 (g) + 6 161 kJ
O pH de uma solução 0,001 mol/L de NaOH a 25 °C em relação a uma solução 0,0001 mol/L da mesma substância à mesma temperatura será
Dados:
Kw = 1,0 × 10−14
Considere o sistema tampão entre ácido acético e acetato de sódio. A relação necessária entre concentração de base conjugada e seu ácido, para que o pH da solução tampão seja igual a 7 será
Dados:
pKa (ácido acético/acetato de sódio) = 4,74
Considere os seguintes compostos:

São isômeros trans e cis do isoeugenol os compostos
Sabendo que a reação apresentada mostra o processo de oxidação do etanol — em que são liberadas 327 kcal por mol de energia — e que as massas atômicas do carbono, do oxigênio e do hidrogênio são, respectivamente, iguais a 12, 16 e 1, julgue o item a seguir.
Álcool etílico hidratado é uma mistura homogênea.
Sabendo que a reação apresentada mostra o processo de oxidação do etanol — em que são liberadas 327 kcal por mol de energia — e que as massas atômicas do carbono, do oxigênio e do hidrogênio são, respectivamente, iguais a 12, 16 e 1, julgue o item a seguir.
Para cada mol de água produzido, a energia liberada é de
109 kcal.
Sabendo que a reação apresentada mostra o processo de oxidação do etanol — em que são liberadas 327 kcal por mol de energia — e que as massas atômicas do carbono, do oxigênio e do hidrogênio são, respectivamente, iguais a 12, 16 e 1, julgue o item a seguir.
Para cada mol de etanol, a quantidade de O2 consumida é de
48 g.
Sabendo que a reação apresentada mostra o processo de oxidação do etanol — em que são liberadas 327 kcal por mol de energia — e que as massas atômicas do carbono, do oxigênio e do hidrogênio são, respectivamente, iguais a 12, 16 e 1, julgue o item a seguir.
Para cada mol de etanol, são liberados 88 g de CO2.
Sabendo que a reação apresentada mostra o processo de oxidação do etanol — em que são liberadas 327 kcal por mol de energia — e que as massas atômicas do carbono, do oxigênio e do hidrogênio são, respectivamente, iguais a 12, 16 e 1, julgue o item a seguir.
A massa de 1 mol de etanol é 46 g.
