Questões de Concurso Comentadas sobre química
Foram encontradas 7.320 questões
A reação de oxirredução que ocorre numa pilha de lítio é representada simplificadamente a seguir:
2 Li(s) + I2(s) → 2 Li+ (aq) + 2 I- (aq)
Dados os potenciais padrões de redução:
• Eº Li+ /Li = -3,05 V
• Eº I2 /I- = +0,53 V
verifica-se que a diferença de potencial padrão dessa pilha,
em volts, é
Ao expressar essa energia em termos de massa de glicose, o atleta deve ingerir, em gramas, aproximadamente,
Dado M(C) = 12 g mol-1 M (O) = 16 g mol-1 M(H) = 1 g mol-1
Sabendo-se que a massa de Ne na mistura é 4 vezes maior que a massa de H2 , a pressão parcial do H2 , em atm, teria um valor mais próximo de
Dado M (H2 ) = 2 g mol-1 M (Ne) = 20 g mol-1 (RT/V) = 1 atm mol-1
Com relação às propriedades da água e ao equilíbrio ácido-base, julgue o item a seguir.
Todo par ácido fraco/base conjugada pode agir mais
eficientemente como tampão em valores de pH próximos à
neutralidade (pH = 7).
Com relação às propriedades da água e ao equilíbrio ácido-base, julgue o item a seguir.
Por ser um ácido fraco, o ácido lático dissocia-se parcialmente
em água, formando lactato e H+
, até atingir um equilíbrio
químico.
Com relação às propriedades da água e ao equilíbrio ácido-base, julgue o item a seguir.
Eletrólitos são substâncias que se ionizam em água, formando
cátions e ânions.
Com relação às propriedades da água e ao equilíbrio ácido-base, julgue o item a seguir.
A natureza química da água faz desta um excelente solvente
para moléculas apolares.
A reação química representada a seguir corresponde à combustão do etanol a 20 °C:
C2 H6 O (l) + 3 O2 (g) → 2 CO2 (g) + 3 H2 O (g)
Três grandezas termodinâmicas associadas à essa reação são:
ΔH = variação de entalpia
ΔS = variação de entropia
ΔG = variação da energia livre de Gibbs
Analisando-se a reação em relação a essas grandezas, constata-se que
A reação a seguir é muito útil em procedimentos para determinação do teor de ferro.
SnCℓ2 (aq) + 2 FeCℓ3 (aq) → SnCℓ4 (aq) + 2 FeCℓ2 (aq)
Sobre essa reação, na direção da formação dos produtos, tem-se que
Dado
Eº (Fe3+/Fe2+) = +0,77 V
Eº (Sn4+/Sn2+) = +0,15 V
A estrutura química de um hidrocarboneto é representada abaixo:
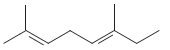
A cadeia carbônica desse hidrocarboneto é
Uma solução salina foi preparada pela dissolução completa de 0,71 g de Na2 SO4 e 1,17 g de NaCℓ, tendo o volume final ajustado, com água destilada, para 250,00 mL num balão volumétrico.
A concentração, em mol L-1 , do íon sódio na solução é
Dado
M (Na2 SO4 ) = 142,0 g mol-1
M (NaCℓ) = 58,5 g mol-1
O alumínio reage de forma bastante energética quando colocado em solução aquosa concentrada de NaOH, produzindo um precipitado, o tetrahidroxialuminato de sódio, e gás hidrogênio, conforme se explicita na equação química a seguir.
2 Aℓ (s) + 2 NaOH (aq) + 6 H2 O (l) → 2 NaAℓ(OH)4 (s) + 3 H2 (g)
O rendimento percentual da reação é de 90%. A partir de 81,0 g de alumínio em pó, adicionado em meio aquoso onde se garante excesso de NaOH, o volume de gás, em litros, produzido (considerando-se 1 atm de pressão, a 298 K e comportamento ideal) é mais próximo de
Dado
M (H2 ) = 2 g mol-1
M (Aℓ) = 27 g mol-1
R = 0,082 atm L mol-1 K-1
R × T = 24,4 atm L mol-1
A espermina é uma substância que é encontrada no fluido seminal e está representada abaixo.
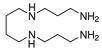
Na estrutura dessa molécula, tem-se o seguinte:
A configuração eletrônica define, em grande parte, as propriedades químicas dos elementos.
O tálio é um elemento metálico e representativo, que tem configuração eletrônica terminada com elétrons nos orbitais:
Alguns ácidos do elemento enxofre são: ácido sulfuroso, ácido tiossulfúrico, ácido sulfídrico e ácido sulfúrico.
As fórmulas químicas desses ácidos estão, respectivamente, apresentadas em:
O modelo atômico clássico que conhecemos é fundamentado nos modelos desenvolvidos nos séculos XIX e XX, em que foi possível determinar a presença dos prótons, nêutrons e elétrons.
Sendo assim, o modelo que demonstrou, teórica e praticamente, a estrutura que conhecemos atualmente foi o modelo de