Questões de Concurso Comentadas sobre química
Foram encontradas 7.320 questões
Dados: Massa atômica (g/mol): Cu = 63,5
Constante de Faraday = 96500 C/mol (Coulombs por mol de elétrons)
Reação no cátodo: Cu2+ (aq) + 2 e− → Cu(s)
A figura abaixo mostra um equipamento de laboratório para filtração a vácuo.
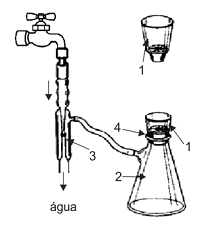
Os componentes indicados pelos números 1, 2, 3 e 4 correspondem, respectivamente, a
Considere a figura abaixo.
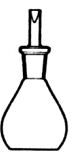
A figura refere-se ao material de laboratório conhecido como
Na determinação da Demanda Química de Oxigênio (DQO) o excesso de dicromato utilizado como oxidante é titulado pelo sulfato ferroso amoniacal, segundo a reação iônica mostrada abaixo.
Fe2+ + Cr2 O2-7 + H+ → Fe3+ + Cr3+ + H2O
A soma dos coeficientes que tornam a reação corretamente balanceada é
Leia o texto a seguir e responda à questão.
Uma das etapas do tratamento da água é a fluoretação e, para isto, utiliza-se o ácido fluossilícico (H2SiF6 ), um subproduto da indústria de fertilizantes. É um líquido altamente solúvel e corrosivo, o que dificulta o seu transporte e requer reservatórios apropriados. Os locais para sua armazenagem devem ser frescos e ventilados, em virtude sua natureza tóxica, pois, ao vaporizar-se, decompõe-se em ácido fluorídrico e tetrafluoreto de silício.
Fonte: Manual de Fluoretação da Água para consumo humano. Fundação Nacional de
Saúde (Funasa). Ministério da Saúde. Disponível em:<http://www.funasa.gov.br/site/wpcontent/files_mf/mnl_fluoretacao_2.pdf>
Qual é a quantidade necessária de ácido clorídrico concentrado (37%) para preparar 200 mL de uma solução de ácido clorídrico a 0,4 M?
Dados: (massa específica HCl = 1,19g/mL; massa molecular em gramas 36,5 g/mol)
O minério magnetita é formado pelo seguinte processo:
3FeO (s) + CO2 (s) à Fe3O4 (s) + CO (g)
Quantos mols, aproximadamente, de dióxido de carbono são necessários para reagir com 750 g de óxido de ferro(II)?
Dados:
(massa molar do FeO = 71 g/mol; massa
molar do CO2 = 44 g/mol)
Observe a curva de titulação do ácido fosfórico H3PO4 . As setas indicam a faixa de pH onde predominam seus íons correspondentes.
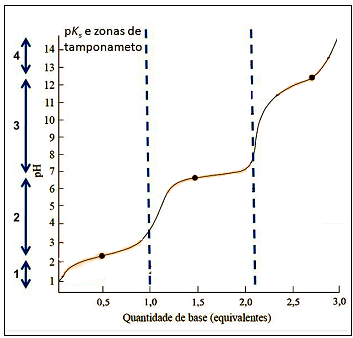
Em qual faixa de pH predomina o íon HPO42-?
Um feixe de luz laser de comprimento de onda λ0 atravessa uma solução coloidal e é espalhado pelas partículas de forma que a intensidade da luz espalhada é I0 .
Se dobrarmos o comprimento da luz do laser, a nova intensidade espalhada será
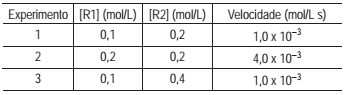
A equação química abaixo é da reação, que ocorre no estado gasoso, entre dois reagentes (R1 e R2 ) formando um produto único P.
R1(g) + R2(g) → P(g)
De um conjunto de experimentos foram coletados dados
que foram organizados na seguinte Tabela:
A seguir é mostrada a equação da reação entre cloro e estireno.
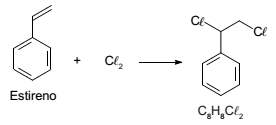
Sobre a reação, seus reagentes e o produto listam-se abaixo três afirmativas:
I - Os átomos de cloro no produto estão na configuração cis.
II - Em relação ao estireno, o produto clorado tem maior massa molar.
III - O estireno é um hidrocarboneto alifático.
Está correto APENAS o que se afirma em
Uma solução foi preparada com a mistura de 360 g de água pura com 160 g de um solvente orgânico. Em uma certa temperatura, a pressão de vapor da mistura foi 4,3 kPa. Com base no valor da pressão de vapor da mistura, e nas opções abaixo, pode-se concluir que o solvente orgânico usado foi
Dados:
• Pressão de vapor da água pura: 2,0 kPa
• Pressão de vapor do solvente orgânico: 13,5 kPa
• M (água) = 18,00 g mol-1
Uma amostra de minério (20,00 g) foi previamente solubilizada com uma mistura de ácidos inorgânicos e posteriormente diluída com água para ajustar seu volume para 1,00 L. Dessa solução, separam-se 250,00 mL que foram colocados em uma célula de um sistema eletrogravimétrico. Após a aplicação de um potencial adequado, o cobre da solução foi depositado, seletivamente, na superfície de um eletrodo de platina (em forma de rede para se ter elevada área superficial).
Se a massa de cobre depositada no eletrodo foi igual a 1,55 g, a percentagem (m/m) no minério é
A concentração de vitamina C (C6 H8 O6 ) foi determinada por coulometria usando eletrodo de platina. No processo, aplicou-se uma diferença de potencial para formar I- , a partir de um excesso de I2 presente na solução onde a amostra foi adicionada. A espécie I3- (formada a partir de I- e I2 ) reagiu com a vitamina C, oxidando-a (ver equações a seguir).
C6 H8 O6 + I3 - → C6 H6 O6 + 3I- + 2 H+
Em que I3 - + 2e → 3I-
Sabe-se que 25,00 mL de solução de amostra foram adicionadas à célula coulométrica, e que foram requeridos 12 min e
52 s da aplicação de 25 mA de corrente para oxidar quantitativamente a vitamina C.
Com base nessa informação, a concentração de vitamina C (em mol L-1 ) na solução de amostra é de
Dado
Carga de 1 mol de elétrons = 96500 C
C = A s
O enxofre do H2S dissolvido em água pode ser precipitado por um processo eletrolítico, como indicado na equação a seguir.
H2 S(aq) + I2(aq) → S(s) + 2H+ (aq) + 2I- (aq)