Questões de Concurso Comentadas sobre química
Foram encontradas 7.320 questões
Considere a pilha ilustrada na figura a seguir, em que as soluções de ZnSO4 e CuSO4 foram empregadas com concentração inicial de 1 mol/L.
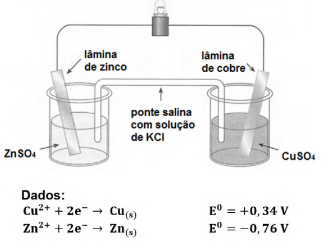
Acerca da situação apresentada, assinale a alternativa INCORRETA.
O estoque de uma companhia possuía resinas termofixas e termoplásticas. Um estagiário precisava apanhar os recipientes das duas únicas resinas termofixas que estavam nesse estoque.
Os recipientes escolhidos foram de
Uma solução de NaCℓ foi feita dissolvendo, totalmente, 0,100 g do sal em água antes de transferir essa mistura para um balão volumétrico de 100,00 mL onde a solução teve seu volume ajustado. A incerteza da massa de NaCℓ é 0,001 g (calculada considerando duas etapas: a tara e a pesagem propriamente dita do sal), e a incerteza do balão é 0,10 mL.
Assim, essa solução teria uma incerteza de concentração, em gL-1 , de
O potencial padrão de redução do Fe3+ (ver equação I) é +0,77 V em relação ao eletrodo padrão de hidrogênio (EPH). O eletrodo de referência de calomelano, ou Hg/Hg2Cℓ2 (KCℓsat), tem potencial de redução (ver equação II) igual a +0,24 V em relação ao EPH.
I - Fe3+ (aq) + e → Fe2+ (aq) E° = +0,77 V
II - Hg2Cℓ2(s) + e → 2 Hg(ℓ) + 2 Cℓ- (aq) E° = +0,24 V
Assim sendo, o potencial de redução padrão do Fe3+, em V, em relação ao eletrodo de referência de calomelano é
Uma solução de álcool desinfetante foi preparada, a 20°C, com água e etanol, sendo que a quantidade desse último na mistura foi de 71,2% massa/massa. O valor aproximado da pressão de vapor da mistura, em mmHg, é
Dados
Pressão de vapor do etanol puro: 44 mmHg a 20°C
Pressão de vapor da água pura: 18 mmHg a 20°C
M (água) = 18,00 g mol-1
M (etanol) = 46 g mol-1
Uma solução ideal foi feita misturando 360,00 mL de água e 1 mol de um soluto não volátil, armazenando a mesma a 20°C.
O valor aproximado da pressão de vapor, em mmHg, da mistura é
Dados
Pressão de vapor da água pura: 18 mmHg a 20°C
Massa específica da água pura: 1,00 g mL-1
M (H2O) = 18,00 g mol-1
Um procedimento gravimétrico foi realizado de acordo com as instruções da literatura. Um precipitado foi obtido após a mistura da solução de amostra com a solução do reagente precipitante (esta última adicionada em quantidade para garantir excesso estequiométrico). Por conta das características do precipitado, uma fração ficou suspensa na solução (suspensão coloidal) e foi perdida na filtragem para recolher o sólido. Após secagem, a massa final do precipitado foi medida em balança calibrada. O procedimento foi repetido três vezes para se obter um valor médio de massa de analito e seu desvio padrão.
Com relação aos erros associados ao resultado, tem-se
No procedimento de extração líquido-líquido, em um funil de extração, uma espécie química alvo (analito), dissolvida num solvente (denominado aqui de solvente original), é extraída para outro solvente (denominado aqui de solvente extrator) de diferente polaridade, tirando vantagem de uma partição favorável do analito para o solvente extrator. A constante de partição (Kf ) é dada pela razão entre as concentrações do analito no solvente extrator (Solv-ext) e no solvente original (Solv-orig).
Kf = [analito]Solv-ext. / [analito]Solv-orig.
Um copo Becher contém uma solução aquosa onde duas substâncias estão dissolvidas. Essa solução foi tratada com um reagente que formou um precipitado ao reagir com uma das substâncias. Todo o material foi transferido para um funil, com membrana, acoplado a um Kitasato conectado a uma torneira por uma trompa. Após filtragem, a solução do Kitassato foi transferida para um placa de Petri, que foi colocada numa estufa a 60°C. Após 24 h, o filme sólido na placa foi raspado e colocado em um frasco âmbar com tampa.
Com base no procedimento descrito, identificam-se quais métodos de separação?
Uma solução padrão de um corante foi colocada na cubeta de quartzo (1,00 cm de caminho óptico) de um espectrofotômetro. O percentual de radiação (em 550 nm) transmitida através da solução foi de 10%, valor já corrigido em relação à contribuição do solvente. A absortividade molar, em 550 nm, do corante é 10.000 L mol-1 cm-1 , e o resultado experimental se encontrava na faixa linear regida pela Lei de Beer-Lambert.
A concentração, em mol L-1 , do corante na solução é
As cromatografias líquida e gasosa são importantes técnicas analíticas que permitem a análise de amostras contendo várias espécies químicas.
Em um cromatograma típico, apresenta-se
Um volume igual a 2,00 mL de uma amostra de ácido muriático (ácido clorídrico comercial) foi transferido para um balão volumétrico e diluído, com água destilada, até o volume de 250,00 mL. Com auxílio de pipeta volumétrica, transferiu-se uma alíquota de 25,00 mL para um frasco Erlenmeyer contendo 100 mL de água. Essa alíquota foi titulada com solução aquosa padronizada de NaOH (0,100 mol L-1 ), e o ponto final, detectado com o indicador apropriado, foi atingido com 21,00 mL.
Nessas condições, a concentração, em mol L-1 , de HCℓ no ácido comercial é
Uma amostra de minério (5,00 g) foi completamente dissolvida em ácido e o volume ajustado para 100,00 mL. Uma alíquota de 10,00 mL dessa solução aquosa foi misturada, de forma lenta e sob agitação constante, com excesso de solução aquosa de hidróxido de amônio, suficiente para promover a precipitação completa de ferro na forma de Fe(OH)3 .
Fe3+ (aq) + 3OH- (aq) → Fe(OH)3 (s)
Após envelhecer, em sua água mãe, filtrar e lavar, o precipitado foi calcinado em forno mufla para formar Fe2O3 , que depois foi deixado para resfriar, em dessecador, até massa constante.
2 Fe(OH)3(s) → Fe2O3(s) + 3H2O(g)
Sendo a massa de Fe2O3(s), obtida após a calcinação, igual a 3,84 g, o valor mais próximo da percentagem (massa/ massa) de ferro no minério é
Dado
M (Fe) = 56 g mol-1
M (Fe2O3
) = 160 g mol-1
Uma mistura gasosa denominada de ARGOMETA P10 contém 10%, em massa, de metano e argônio em quantidade para fechar o balanço da composição. Considere que um recipiente, de volume igual a 100 L, está preenchido somente com 100 g de ARGOMETA P10.
Considerando condições ideais, a pressão parcial do metano no recipiente, em atm e a 298 K, é, aproximadamente, igual à
Dados
M (CH4 ) = 16 g mol-1
M (Ar) = 40 g mol-1
R = 0,082 atm L mol-1
K-1
O acetaldeído ou etanal é um aldeído que se decompõe segundo a equação abaixo:
CH3 CHO(g) → CH4(g) + CO (g)
A reação tem cinética de segunda ordem, e o valor da constante de velocidade, numa dada temperatura, é 9,0 × 10-5 L mol-1 s-1 .
O valor mais próximo da velocidade inicial de decomposição de 200 g de acetaldeído, dentro de um reator de 10 L, é
Dado
M(CH3
CHO) = 44 gmol-1
O equilíbrio de dissociação da água é mostrado na equação de equilíbrio a seguir:
H2O ⇋ H+ + OH-
A 25°C, a constante de equilíbrio (Kw) é dada por:
Kw = [H+] [OH- ] = 1,0 x 10-14
Ao se misturarem 50 mL de uma solução aquosa do ácido
forte HCℓ (0,01 mol L-1
) com 20 mL de solução aquosa da
base forte KOH (0,02 mol L-1
) e água suficiente para se
levar o volume final a 100 mL, o pH da solução resultante,
a 25°C, será
Uma mistura ácida é feita com 100,00 mL de solução aquosa 1,00 mol L-1 de HCℓ e 250,00 mL de solução aquosa 2,00 mol L-1 de HNO3 , ajustado, com água, o volume final para 1,0 L. Uma alíquota de 100,00 mL dessa mistura de ácidos foi coletada e neutralizada com solução 0,50 mol L-1 de NaOH.
O volume, em mL, da solução de base forte que foi necessário para promover a neutralização foi
O rótulo de um frasco de solução de ácido nítrico concentrado (com 65% de HNO3 m/m) indica que 1,0 L tem massa igual a 1,4 kg. Deseja-se preparar 250 mL de uma solução 3,0 mol L-1 de HNO3 , com apenas uma etapa de diluição do ácido concentrado com água pura.
Para tal preparação, o volume aproximado de ácido necessário, em mL, é
Dados
M (HNO3
) = 63 g mol-1
A reação representada na equação abaixo é lenta e reversível, mas seu rendimento é melhorado com a adição de quantidades catalíticas de ácido sulfúrico.
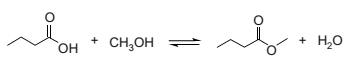
Nessa reação,