Questões de Concurso Comentadas sobre química
Foram encontradas 7.320 questões
As afirmações abaixo estão relacionadas à fonte de ionização por impacto de elétrons (EI) empregada na espectrometria de massas.
I) Aplicada a moléculas de média e de baixa polaridade em qualquer faixa de massa molecular.
II) Empregada na determinação da massa molecular dos compostos devido ao aparecimento do íon molecular em todos os espectros de massas.
III) Empregada na identificação de compostos devido ao grande número de fragmentos formados.
IV) Aplica-se a moléculas de média e de baixa polaridade em analitos com massa molecular inferior a 1.000 daltons.
Assinale a alternativa com as afirmações corretas.
Considere as afirmações abaixo sobre os modos de injeção de amostras empregados na técnica de cromatografia em fase gasosa.
I) No modo Split (com divisor de fluxo), a amostra é dividida antes de entrar na coluna.
II) No modo Splitless (sem divisor de fluxo), toda amostra entra na coluna.
III) No modo Split (com divisor de fluxo), a amostra é dividida antes de entrar na coluna, sempre na razão de 1:50.
IV) No modo Split (com divisor de fluxo), toda amostra entra na coluna.
Assinale a alternativa com as afirmações corretas.
Assinale a alternativa que completa corretamente a lacuna.
“Para o preparo de 1L (litro) de solução de Hidróxido de Sódio (NaOH) 10M (molar), é necessário adicionar __________ de hidróxido de sódio (NaOH) em 500mL (mililitros) de água destilada e após, completar o volume para 1L (litro) com água destilada.”
Considere os seguintes tipos de materiais vegetais:
• Folhas de coca (Erythroxylum coca), das quais se extraem o alcalóide cocaína (observação: comporta-se como base fraca).
• Folhas de maconha (Cannabis sativa) das quais se obtém diferentes canabinóides, dentre os quais, o delta-9 tetraidrocanabinol (delta-9 THC), molécula de baixa hidrossolubilidade.
Para a extração dos princípios ativos desses materiais vegetais, um laboratório forense dispõe dos seguintes sistemas de solventes para extração:
I. Clorofórmio acrescido de ácido acético glacial (H3C-COOH).
II. Clorofórmio (CHCl3) acrescido de hidróxido de amônio.
III. Clorofórmio puro (CHCl3).
IV. Tolueno (hidrocarboneto aromático de fórmula: C7H8).
V. Solução aquosa 10-5 mol/L de ácido clorídrico.
VI. Solução aquosa 10-5 mol/L de hidróxido de sódio.
VII. Água pura.
Considerando que os sistemas de solventes já foram exaustivamente testados e que não causarão degradação dos princípios ativos e que os protocolos de extração do laboratório preveem o uso sempre da mesma quantidade de material vegetal e de solventes (todos em temperatura ambiente) para todas as metodologias de extração, assinale a alternativa INCORRETA.
Álcoois são de grande versatilidade do ponto de vista sintético, pois podem participar de uma série de reações. Exemplos dessa versatilidade são mostrados nas reações não balanceadas nas quais apenas o produto principal é mostrado:
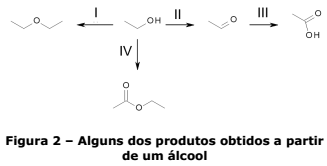
Sobre essa reação e os compostos nela
envolvidos, assinale a alternativa INCORRETA.
Em uma ação policial para combate ao tráfico de substâncias psicoativas (“drogas de abuso”), foram apreendidos 10.000 (dez mil) tubos plásticos, de formato cônico, do tipo eppendorf, com volume de 1,5 mL, cujo interior apresentava sólido pulverizado de coloração bege, que preenchia um volume de 1,0 mL de cada um dos tubos. Durante o exame preliminar do material, foram feitas as seguintes observações:
• Todos os tubos apresentavam as mesmas dimensões e foram preenchidos com o mesmo volume, massa e tipo de pó.
• A massa do material apreendido (correspondente à soma da massa dos tubos e do pó contido em todos os tubos) era de 15.000g (quinze mil gramas).
• A massa de 10 tubos, obtida após a remoção completa do pó de cada um deles, era de 10,0g.
Além disso, por meio de técnicas de amostragem e analíticas, determinou-se que o pó, em todos os tubos, apresentava um teor de cocaína de 5,0%.
Em um laboratório de análise química, há três tambores plásticos (X, Y e Z) destinados ao descarte de soluções e nos seus rótulos se lê os seguintes dizeres:
• Tambor X: descarte de soluções ácidas.
• Tambor Y: descarte de soluções básicas.
• Tambor Z: descarte de soluções neutras.
Ao perito desse laboratório, foi solicitado que fizesse o descarte de 3 soluções aquosas (1, 2 e 3), cujas características são descritas a seguir:
• Solução 1: cloreto de sódio 0,1 mol/L.
• Solução 2: mistura de 50 mL de ácido clorídrico 0,2 mol/L, com 20 mL de hidróxido de sódio 0,5 mol/L.
• Solução 3: glicose 0,1 mol/L (lembrando que a glicose é poliálcool que apresenta ainda um grupo aldeído (C6H12O6(aq))).
Considerando que o correto descarte tenha sido feito pelo perito, assinale a alternativa correta.
O ferro metálico pode ser obtido industrialmente por meio da seguinte reação não balanceada:
Fe2O3(s) + CO(g) → Fe(s) + CO2(g)
Considerando uma reação com transformação
total de produtos em reagentes, assinale a
alternativa correta sobre esse processo.
O carbureto (carbeto de cálcio) é um sólido empregado tanto para iluminação quanto para processos de solda, devido à formação de acetileno (C2H2), quando da sua exposição à água, de acordo com a equação não balanceada:
CaC2(s) + H2O(l) → Ca(OH)2(aq) + C2H2(g)
Uma amostra de 10g de um sólido contendo 40,0% de carbeto de cálcio foi colocada em 200g de água, produzindo acetileno. Considere que as impurezas são imiscíveis em água e não interferem na produção de acetileno e que, na reação, todo o carbureto foi convertido em acetileno. Com base no exposto, a quantidade mais próxima de acetileno produzida e o pH do meio aquoso após a reação serão: Dados:massas molares: H: 1g/mol; C: 12g/mol; O: 16g/mol; Ca:40g/mol
solubilidade do Ca(OH)2(aq) = 1,2g/L