Questões de Concurso Comentadas sobre química
Foram encontradas 7.275 questões
H2 N-CH2 -CH2 -CH2 -CH2 -NH2(aq) + 2 H+ (aq) ⇌ +H3 N-CH2 -CH2 -CH2 -CH2 -NH3 + (aq)
Nesse sistema, verifica-se que o(a)
Baseado no tamanho e no grau de espalhamento de luz incidente, calculou-se em 1 × 10-5 mol L-1 a concentração de AgNP na dispersão. A partir do tamanho médio, determinou-se que haveria 500 átomos de Ag por nanopartícula.
Considerando-se esses dados, verifica-se que a massa de prata, em mg, presente em 1 mL de dispersão é
Dado 1 mol = 6 x 1023 unidades M (Ag) = 108 g mol-1
NaHCO3(s) + H3 O+ (aq) → Na+ (aq) + 2H2 O(l) + CO2(g)
Considerando-se a proporção estequiométrica e o rendimento completo de reação, a massa de bicarbonato de sódio necessária para neutralizar 20,0 L de solução aquosa, cujo pH medido foi 2, é
A concentração, em mol L-1 , do hidróxido na solução é
Dado M(NaOH) = 40 g mol-1
A concentração do princípio ativo, em g L-1 , dessa solução final é, aproximadamente,
CaCO3(s) → CaO(s) + CO2(g); ΔH0 = +179 kJ
Considerando-se o comportamento ideal do gás e o rendimento máximo da reação, a energia necessária, em MJ, para produzir 36 m3 de CO2 , medido nas condições normais de temperatura e pressão (CNTP) é, aproximadamente,
Dado R × T = 24,4 atm L mol-1 M = 106
S(s) + O2(g) → SO2(g)
A reação do enxofre foi completa, e a massa da matéria prima era 80,0 kg.
A partir dessa informação, a percentagem, em massa, de enxofre elementar na matéria prima é, aproximadamente,
Dado R = 0,082 atm L mol-1 K-1
Nessa situação final, a temperatura do balão, em K, é
Dado T(K) = T(°C) + 273
O número de elétrons que estão sendo compartilhados para formar a ligação covalente é igual a
Segundo Almeida (2013), os produtos químicos de um laboratório devem ser separados e armazenados de acordo com seu grupo de risco e incompatibilidade química específica. Dessa forma, analise as informações a seguir:
I. Ácidos oxidantes devem ser armazenados juntos de ácidos orgânicos.
II. Ácidos devem estar separados das bases, de metais reativos como o sódio, magnésio e potássio.
III. As soluções de hidróxidos inorgânicos devem estar armazenadas em frascos de vidro.
IV. Compostos que formem peróxidos devem ser armazenados em recipientes que não deixem entrar o ar e luz.
V. Compostos higroscópicos devem estar armazenados em ambiente úmido e fresco.
Estão corretas as afirmações:
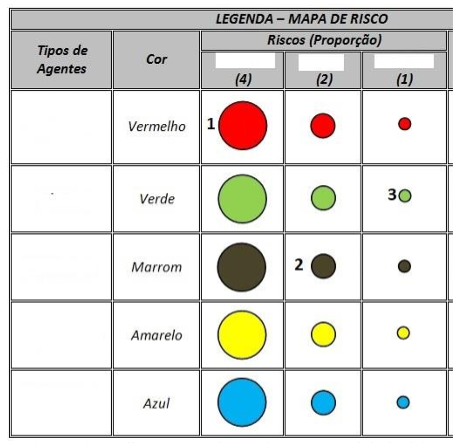
Disponível em: <https://pronatecturismo.blogspot.com/p/principios-de-saude-eseguranca-no.html>. Acesso em: 04 out. 2023.
Os números 1, 2 e 3 no mapa representam, respectivamente:
Observe o quadro a seguir. Ele mostra o visor de pipetas automáticas e seus respectivos números de volumes.
P20 – 125
P100 – 050
P200 – 150
P1000 – 0275
Os volumes de solução nas pipetas P20, P100, P200 e P1000 são, respectivamente: