Questões de Concurso Sobre química
Foram encontradas 13.490 questões
[Feº (s) l Fe2+ (aq) (1 mol/ L) II Pb2+(aq) (1mol/L) I Pbº (s) ]
Nessa pilha, a espécie química que atua como oxidante é:
2 NO (g) + H2 (g) → N2O (g) + H2O g)
A ordem global dessa reação é igual a:
CaCO3+ 2 HCI → CaCL2 + H2O + CO2
Neste experimento verificou-se a formação de 7,92 g de CO2 e consumo completo do CaCO3. Admitindo que as impurezas não participaram da reação, o grau de pureza da amostra é igual a:
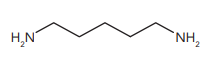
Esse composto pertence a função orgânica denominada:
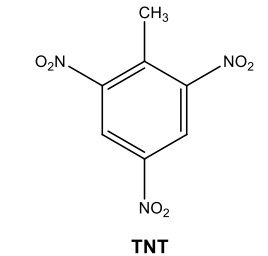
A obtenção desse explosivo, cuja molécula é visualizada acima, é possível devido
( ) Deve-se ligar o exaustor sempre que houver escape de vapores ou gases no laboratório. ( ) As substâncias não utilizadas devem ser retornadas para o frasco de onde foram tiradas. ( ) Ao aquecer um tubo de ensaio contendo qualquer substância, volte à extremidade aberta para si mesmo ou para uma pessoa próxima. ( ) Sempre que proceder à diluição de um ácido concentrado, adicione-o lentamente, sob constante agitação sobre a água e nunca a água sobre o ácido.
Assinale a sequência correta.
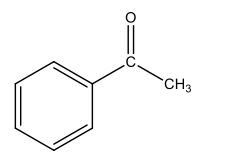
Assinale a alternativa que apresenta o reagente para a síntese dessa molécula
luz e clorofila 6 H2O (I) + 6 CO2 (g) → C6H12O6 (aq) + O2 (g)
Sobre essa reação química, é correto afirmar:
1- Pilha seca comum
( ) Não forma amônia como camada isolante.
2- Pilha alcalina
( ) Sua semirreação catódica é:
2 Ni(OH)3 (s) + 2e → 2 Ni(OH)2 (s) + 2 OH– (aq)
3- Pilha de mercúrio
( ) Emprega sais dissolvidos em solventes não aquosos.
4- Bateria de hidreto metálico
( ) Contém pasta úmida de ZnCl2, NH4Cl e H2O.
5- Bateria de íons lítio
( ) É adequada para dispositivos sensíveis, como aparelhos desurdez, instrumentos científicos e relógios.
Assinale a sequência correta.
CO (g) + CL2 (g) → COCl2 (g)
Sabendo que o grau de equilíbrio é 80%, o cálculo de Kc para esse experimento deverá apresentar o resultado aproximado de
HCI (aq) + KOH (aq) → KCI (aq) + H2O (I)
Após os cálculos, esse pós-graduando concluiu que o pH da solução resultante é igual a:
Dados: αHCl = 100%, Log 5 = 0,7 Massas Molares em g/mol: H = 1; O = 16; Cl = 35,5; K=39,1
Reação de combustão completa do butano (não balanceada):
C4H10 (g) → CO2 (g) + H2O (I) ΔHcº = 2.808 kJ/mol
Dados: Massas Molares em g/mol: H =1; C =12; O = 16
2 H2 (g) + 2 NO (g) → N2 (g) + 2 H2 O (v)
A reação foi repetida três vezes, alterando-se a concentração de um ou de ambos os reagentes e mantendo-se a temperatura constante. Os valores de concentração empregados e os valores de velocidade medidos encontram-se na tabela abaixo:

Observando as regularidades entre as concentrações e as velocidades, a lei de velocidade dessa reação deve ser igual a:
Dados: Massas Molares (em g/mol): H=1; C=12; O=16