Questões de Concurso Sobre química
Foram encontradas 13.542 questões
O Ca(OH)2 é ____________, ou seja, em solução aquosa está ____________.
Referente à seguinte reação:
Mg (s) + O2 (g) MgO(s) ------------>
analise as assertivas e assinale a alternativa que aponta as corretas.
I. É uma reação de combinação.
II. A molécula de oxigênio é formada por ligação iônica.
III. A queima de 2 mol de Mg(s) resulta em 1 mol de MgO.
IV. O produto da reação é um sólido iônico.
Em relação às seguintes moléculas,assinale a alternativa INCORRETA.
1. Forças de London. 2. Ligação de hidrogênio. 3. Dipolo-dipolo.
( ) H2S ( ) NH3 ( ) I2
As substâncias húmicas presentes nos solos, nos sedimentos e nas águas naturais são formas importantes de distribuição da matéria orgânica na Terra.
O controle das propriedades físicas e químicas dos vários ambientes naturais está relacionado à presença dessas substâncias.
Assinale a opção que apresenta propriedades das substâncias húmicas.
Foi detectada a presença de 32µg de dióxido de enxofre em 100L de ar de um recinto fechado que se encontra a 25°C (a 1 atm).
A composição em ppm (v/v) desse poluente no recinto, considerando o comportamento ideal dos gases, é aproximadamente igual a
Dados: Constante dos gases = 0,082 atm.L.mol–1 .K–1 . Massa molares (g.mol–1 ): S = 32 e O = 16
A quantidade de matéria orgânica em águas superficiais e residuais pode ser expressa por meio da demanda química de oxigênio (DQO).
A principal reação para estimar o teor de material orgânico em águas pode ser representada como:
matéria orgânica + (Cr2O7 )2- + H+ ⇄ 2 Cr3+ + CO2 + H2O
Sobre essa reação, analise as afirmativas a seguir.
I. A matéria orgânica é reduzida formando CO2 .
II. O dicromato atua como agente oxidante.
III. O dicromato doa elétrons para a matéria orgânica formar CO2 .
Está correto o que se afirma em
O nitrogênio amoniacal é um parâmetro relevante para avaliação da qualidade da água e pode ser determinado pelo método de Kjeldahl.
Utilizando esse método, todo o nitrogênio de uma amostra de um efluente foi adequadamente transformado em amônia que foi recolhida em solução de ácido bórico. Posteriormente o borato formado foi titulado, consumindo 24 mL de solução padrão de ácido sulfúrico 0,5 mol.L-1 .
A massa de nitrogênio (em mg) presente na amostra, é aproximadamente igual a
Dados: Massa molares (g.mol-1) H3BO3 = 62, H2SO4 = 98, NH3 = 17 e N = 14.
Um dos critérios que pode ser utilizado para classificar águas naturais é o de dureza, propriedade que resulta da dissolução de minerais do solo e das rochas ou do aporte de resíduos industriais.
A classificação de águas naturais, de acordo com a dureza, é expressa em função da concentração de
Os ciclos biogeoquímicos contribuem para a troca de matéria e energia entre a hidrosfera, a atmosfera e a litosfera.
O ciclo hidrológico está relacionado à distribuição da energia solar assim como as propriedades da água estão relacionadas às seguintes funções:
I. ao transporte de nutrientes no meio aquoso.
II. à alta solubilização de espécies iônicas.
III. à flutuação do gelo e à circulação vertical de nutrientes na coluna d’água.
IV. à estabilização da temperatura da biota.
A água realiza essas funções graças às seguintes propriedades:
Na figura a seguir estão representados, de modo resumido, os níveis de conhecimento químico e suas possíveis relações.
Triângulo: Os níveis do Conhecimento Químico
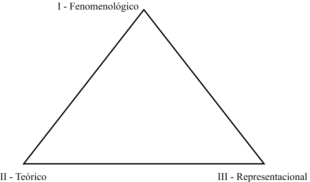
Adaptado de MACHADO, A. H. Aula de Química: discurso e conhecimento. Ed. UNIJUÍ, Ijuí, 2004, p. 163.
Na figura acima, I, II e III, correspondem, respectivamente,
“Em 1868, Mendeleiev estava debruçado sobre o problema dos elementos químicos. Eles eram o alfabeto de que a língua do universo se compunha.”
(STRATHERN, P. O sonho de Mendeleiev. A verdadeira história da química. 2002, Zahar, p. 11).
Com relação à Tabela Periódica proposta por Mendeleiev, analise as afirmativas a seguir.
I. Organizou a tabela em função dos números atômicos dos elementos.
II. Propôs seu nome para um elemento que ainda não havia sido descoberto, o Mendelévio.
III. Deixou lacunas na Tabela quando parecia que o elemento correspondente não tinha sido descoberto.
Assinale:
Leia o fragmento a seguir.
"Os alquimistas do século XIV tornaram-se os primeiros a compreender a natureza dos ácidos. O único ácido conhecido pelos antigos fora o ácido acético fraco do vinagre. No século VIII, Djabir havia preparado uma solução fraca de ácido nítrico e outros alquimistas árabes descobriram que a destilação do vinagre produzia um ácido acético mais forte. Mesmo o ácido acético forte, porém, pouco tinha de corrosivo. Não parecia ser dotado de muito poder reagente.”
(STRATHERN, P. O sonho de Mendeleiev. A verdadeira história da química. 2002, Zahar, p. 57).
Com relação aos ácidos, assinale V para a afirmativa verdadeira e F para a falsa.
( ) O ácido acético pode ser classificado como forte ou fraco dependendo do valor do seu Ka, o que explica as observações obtidas pelos alquimistas.
( ) O ácido nítrico é um ácido fraco, o que corresponde ao observado experimentalmente pelos alquimistas.
( ) Tanto o ácido acético como o ácido nítrico são ácidos fortes, porém os alquimistas não tinham informações suficientes para classificá-los corretamente.
As afirmativas são, respectivamente,
Observe a imagem a seguir.

Fonte: http://o-boqueirao.blogspot.com.br/2013/11/ agrotoxico.html. Acesso em: 10 mar. 2016.)
Na conversa entre a mulher e o vendedor são citados dois grupos denominados genericamente de “agrotóxicos” e “plásticos”.
Sobre esses grupos, é correto afirmar que
O triângulo apresentado a seguir representa objetos de interesse da Química, colocando no centro os materiais e substâncias e, em cada um dos vértices, aspectos diferentes do conhecimento químico com eles relacionados.
Triângulo: Focos de Interesse da Química
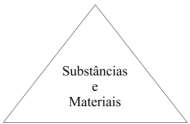
Segundo a proposta de MACHADO, (2014, p. 157) os vértices
desse triângulo devem corresponder aos seguintes aspectos:
O professor propôs, como introdução ao estudo das reações de oxirredução, um experimento bem simples para que o aluno tenha condições de observar um fenômeno que envolve mudanças visuais muito nítidas desse tipo de reação.
No experimento, o aluno deve acrescentar um comprimido de vitamina C não efervescente a uma solução de iodo (farmacêutica) e adicionar água. Nessa reação a vitamina C que é oxidada promove um descoramento da solução de iodo que é reduzido.
A transformação que ocorre no iodo pode ser codificada em uma linguagem química como
Leia o fragmento a seguir.
“A análise refere-se a um trecho da transcrição de uma aula na qual um grupo de alunos vai discutir (...) sobre o fenômeno da queima de uma fita de magnésio. A atividade proposta (...) inclui a realização de cinco testes que correspondem a transformações químicas que são acompanhadas por diferentes evidências.”
(MACHADO, A. H. Aula de Química: discurso e conhecimento. Ed. UNIJUÍ, Ijuí, 3ª ed., 2014.)
Na prática citada com uma fita de magnésio, os alunos observariam as seguintes evidências de transformações químicas:
I. a liberação de energia luminosa.
II. a formação de um sólido branco.
III. a necessidade de aquecimento.
Está correto o que se afirma em