Questões de Concurso Sobre química
Foram encontradas 14.919 questões
Para demonstrar como realizar a separação de misturas, certo professor pediu que os alunos se dividissem em quatro grupos e escolhessem equipamentos que pudessem ser utilizados para separar misturas via sublimação. As escolhas dos grupos estão descritas no quadro a seguir. Observe.

Assinale o grupo que selecionou os equipamentos corretamente para essa separação de misturas.
Solutos iônicos diferem enormemente em sua solubilidade na água. As regras de solubilidade são úteis para prever que precipitado será formado quando duas soluções são misturadas. Reações de precipitação podem ser representadas por equações iônicas líquidas. Os coeficientes na equação iônica líquida para uma reação de precipitação podem ser usados para relacionar o número de moles de reagentes e produtos. Titulações por precipitação são úteis para analisar um componente em uma mistura. Com relação à constante do produto da solubilidade Kps, calculamos:
I. A concentração de um íon na solução em equilíbrio com o sólido quando se conhece a concentração do outro íon.
II. Se haverá ou não formação de precipitado.
III. A solubilidade do sólido em água pura ou em uma solução contendo um íon comum.
Estão corretas as afirmativas
“Na prática não é sempre possível, nem de interesse, ter-se as concentrações iônicas, das espécies presentes, iguais a 1M ou atividade unitária. Assim sendo, tem-se os valores de potenciais diferentes dos apresentados na tabela de potenciais padrão. Para determinação desses novos potenciais, emprega-se a equação de Nernst.”
(Gentil, 2012.)
“Na prática não é sempre possível, nem de interesse, ter-se as concentrações iônicas, das espécies presentes, iguais a 1M ou atividade unitária. Assim sendo, tem-se os valores de potenciais diferentes dos apresentados na tabela de potenciais padrão. Para determinação desses novos potenciais, emprega-se a equação de Nernst.”
(Gentil, 2012.)
Muitas reações envolvem o ganho ou a perda de energia e são chamadas de reações endotérmicas ou exotérmicas. Para o estudo quantitativo desta variação de energia utilizamos ΔH, que é igual à quantidade de calor trocado à pressão constante. Nesse estudo, foram formuladas três leis conhecidas como Leis da Termodinâmica; analise-as.
I. O valor de ΔH é diretamente proporcional à quantidade de reagente ou produto, desde que não haja reagente limitante.
II. O ΔH para uma reação é igual em módulo, mas de sinal contrário ao ΔH da reação inversa, ou seja, a quantidade de calor liberado e a de calor recebido são iguais.
III. O valor de ΔH para uma reação é o mesmo, seja a reação direta ou em etapas.
Corresponde(m) às Leis da Termodinâmica apenas
Analise a figura acerca do ponto triplo.
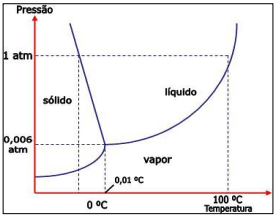
De acordo com a imagem anterior, assinale a alternativa correta.
Vários compostos orgânicos com átomos de halogênios diferentes de cloro foram ou são usados comercialmente. Como exemplo, os fréons são utilizados como propelentes de aerossóis e como gases de refrigerante, o 1,2-dibrometano (EBD) é utilizado como inseticida em grãos, o ácido 2,4-diclorofenoxiacético é utilizado como herbicida. Sabendo qual a função orgânica e como ela se caracteriza no composto, podemos compreender qual uso o composto poderá ter.
Analise, a seguir, a tabela de compostos e alguns usos específicos.

Vários compostos orgânicos com átomos de halogênios diferentes de cloro foram ou são usados comercialmente. Como exemplo, os fréons são utilizados como propelentes de aerossóis e como gases de refrigerante, o 1,2-dibrometano (EBD) é utilizado como inseticida em grãos, o ácido 2,4-diclorofenoxiacético é utilizado como herbicida. Sabendo qual a função orgânica e como ela se caracteriza no composto, podemos compreender qual uso o composto poderá ter.
Analise, a seguir, a tabela de compostos e alguns usos específicos.
