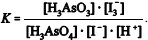Questões de Concurso Sobre química
Foram encontradas 14.919 questões
Uma reação de grande importância do propeno é a hidroformilação: o propeno reage com o chamado gás de síntese — uma mistura de CO(g) e H2(g) — para gerar aldeídos, conforme mostra o esquema seguinte.

O interesse industrial pelas reações de hidroformilação advém do fato de os aldeídos resultantes dessas reações serem compostos muito versáteis, usados como matéria-prima para a preparação de diversos outros compostos. Por exemplo, o butanal pode ser usado na síntese do composto 1, conforme indicado no esquema a seguir.

Além disso, a depender das condições reacionais e do catalisador empregado, reações consecutivas podem suceder a hidroformilação, produzindo diretamente outros compostos, conforme exemplificado no seguinte esquema.

A respeito dos compostos e das reações apresentados, julgue o próximo item.
O H2 é um gás inodoro, explosivo, que pode ser produzido a
partir da reforma catalítica do metano ou da hidrólise da água.
O hidrocarboneto propeno é produzido durante o craqueamento do petróleo e a gaseificação do carvão, junto com outros gases, como o etano e o propano. O propeno, um dos principais insumos da indústria petroquímica, é utilizado como matéria-prima na preparação de outros compostos e, sobretudo, do polipropileno, um polímero de adição do propeno preparado com catalisadores à base de TiCl4 e um trialquilalumínio. Considerando essas informações e que o TiCl4 é um composto molecular com geometria tetraédrica, julgue o item subsecutivo.
A estrutura do polipropileno é corretamente representada abaixo.
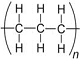
O hidrocarboneto propeno é produzido durante o craqueamento do petróleo e a gaseificação do carvão, junto com outros gases, como o etano e o propano. O propeno, um dos principais insumos da indústria petroquímica, é utilizado como matéria-prima na preparação de outros compostos e, sobretudo, do polipropileno, um polímero de adição do propeno preparado com catalisadores à base de TiCl4 e um trialquilalumínio. Considerando essas informações e que o TiCl4 é um composto molecular com geometria tetraédrica, julgue o item subsecutivo.
Na molécula de propeno todos os átomos se encontram em um mesmo plano.
O hidrocarboneto propeno é produzido durante o craqueamento do petróleo e a gaseificação do carvão, junto com outros gases, como o etano e o propano. O propeno, um dos principais insumos da indústria petroquímica, é utilizado como matéria-prima na preparação de outros compostos e, sobretudo, do polipropileno, um polímero de adição do propeno preparado com catalisadores à base de TiCl4 e um trialquilalumínio. Considerando essas informações e que o TiCl4 é um composto molecular com geometria tetraédrica, julgue o item subsecutivo.
O ponto de ebulição do propeno é superior ao do etano e inferior ao do propano.
O hidrocarboneto propeno é produzido durante o craqueamento do petróleo e a gaseificação do carvão, junto com outros gases, como o etano e o propano. O propeno, um dos principais insumos da indústria petroquímica, é utilizado como matéria-prima na preparação de outros compostos e, sobretudo, do polipropileno, um polímero de adição do propeno preparado com catalisadores à base de TiCl4 e um trialquilalumínio. Considerando essas informações e que o TiCl4 é um composto molecular com geometria tetraédrica, julgue o item subsecutivo.
produto principal gerado é o 1-propanol.
76 A molécula de TiCl4, apresenta quatro ligações covalentes e é
polar.
O hidrocarboneto propeno é produzido durante o craqueamento do petróleo e a gaseificação do carvão, junto com outros gases, como o etano e o propano. O propeno, um dos principais insumos da indústria petroquímica, é utilizado como matéria-prima na preparação de outros compostos e, sobretudo, do polipropileno, um polímero de adição do propeno preparado com catalisadores à base de TiCl4 e um trialquilalumínio. Considerando essas informações e que o TiCl4 é um composto molecular com geometria tetraédrica, julgue o item subsecutivo.
Na reação de hidratação do propeno catalisada por ácido, o
produto principal gerado é o 1-propanol.
Com relação aos métodos instrumentais de análise, julgue o item que se segue.
Tanto na espectroscopia de absorção molecular quanto na
absorção atômica, a amostra é atomizada gerando linhas
espectrais que são absorvidas pela radiação incidente.
Com relação aos métodos instrumentais de análise, julgue o item que se segue.
Analisadores amplamente utilizados na espectrometria de
massa são do tipo quadrupolar. Este tipo de analisador permite,
basicamente, a passagem de íons com uma razão massa-carga
específica. Os analisadores quadrupolares apresentam altas
resoluções.
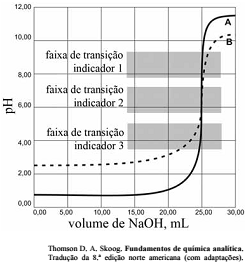
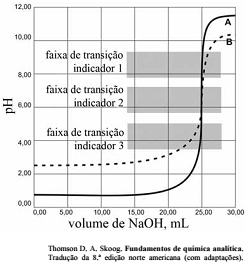
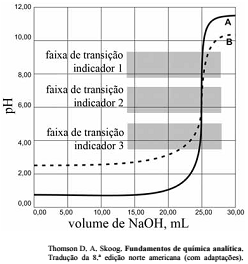
As titulações são amplamente utilizadas em química para identificar os ácidos, as bases, os oxidantes, os redutores, os íons metálicos e as proteínas. Com base nessas informações e na figura acima que apresenta um gráfico de titulação de NaOH, pH em função do volume em mL, julgue o item a seguir.
A titulação representada pela curva A mostra uma solução mais ácida do que a mostrada pela curva B.
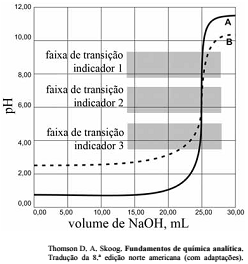
As titulações são amplamente utilizadas em química para identificar os ácidos, as bases, os oxidantes, os redutores, os íons metálicos e as proteínas. Com base nessas informações e na figura acima que apresenta um gráfico de titulação de NaOH, pH em função do volume em mL, julgue o item a seguir.
A figura mostra a titulação de um ácido fraco com uma base forte.
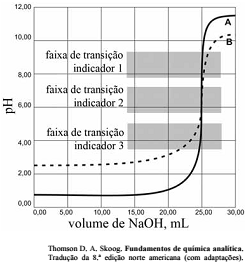
As titulações são amplamente utilizadas em química para identificar os ácidos, as bases, os oxidantes, os redutores, os íons metálicos e as proteínas. Com base nessas informações e na figura acima que apresenta um gráfico de titulação de NaOH, pH em função do volume em mL, julgue o item a seguir.
Soluções padrão de KMnO4 são raramente utilizadas para titular soluções contendo HCl.
As titulações são amplamente utilizadas em química para identificar os ácidos, as bases, os oxidantes, os redutores, os íons metálicos e as proteínas. Com base nessas informações e na figura acima que apresenta um gráfico de titulação de NaOH, pH em função do volume em mL, julgue o item a seguir.
Nas titulações de complexação, quanto maior for a constante de formação do complexo metal-ligante, melhor a seletividade do ligante para o metal, quando comparadas aos complexos semelhantes com outros metais.
As titulações são amplamente utilizadas em química para identificar os ácidos, as bases, os oxidantes, os redutores, os íons metálicos e as proteínas. Com base nessas informações e na figura acima que apresenta um gráfico de titulação de NaOH, pH em função do volume em mL, julgue o item a seguir.
Qualquer um dos três indicadores ácido base mostrados na
figura podem ser usados para titulação de soluções mais
diluídas.
[A] (M) [B] (M) velocidade inicial (m/s)
2,16 0,525 8,05 × 10-3
2,16 1,05 3,22 × 10-2
4,33 0,525 4,03 × 10-3
velocidade = k · [A]m · [B]n
Considerando a reação química geral aA + bB → produtos e as velocidades iniciais, as molaridades e a lei de velocidade mostradas na tabela acima, julgue o item subsequente.
O valor de k é maior que 5,5 × 10-2 s-1.
[A] (M) [B] (M) velocidade inicial (m/s)
2,16 0,525 8,05 × 10-3
2,16 1,05 3,22 × 10-2
4,33 0,525 4,03 × 10-3
velocidade = k · [A]m · [B]n
Considerando a reação química geral aA + bB → produtos e as velocidades iniciais, as molaridades e a lei de velocidade mostradas na tabela acima, julgue o item subsequente.
Os valores de m e n são 2 e -1, respectivamente.
[A] (M) [B] (M) velocidade inicial (m/s)
2,16 0,525 8,05 × 10-3
2,16 1,05 3,22 × 10-2
4,33 0,525 4,03 × 10-3
velocidade = k · [A]m · [B]n
Considerando a reação química geral aA + bB → produtos e as velocidades iniciais, as molaridades e a lei de velocidade mostradas na tabela acima, julgue o item subsequente.
Para a reação de segunda ordem aA + bB → produtos umgráfico de ln [A] versus o tempo é representado por uma reta.
Um dos objetivos principais da cinética química é a determinação das leis da velocidade, isto é, expressões matemáticas simples que informam com que rapidez uma reação química ocorre. Leis de velocidade com formas matemáticas semelhantes pressupõem que as reações que elas representam se comportam de uma mesma maneira, à medida que a reação ocorre. Com relação a esse assunto,julgue o próximo item.
A velocidade de uma reação química indica quantos mols de um reagente estão reagindo ou quantos mols de um produto estão sendo formados durante certo período.
Um dos objetivos principais da cinética química é a determinação das leis da velocidade, isto é, expressões matemáticas simples que informam com que rapidez uma reação química ocorre. Leis de velocidade com formas matemáticas semelhantes pressupõem que as reações que elas representam se comportam de uma mesma maneira, à medida que a reação ocorre. Com relação a esse assunto,julgue o próximo item.
Se a reação química — H2 + O2 → H2O — ocorre a uma velocidade igual a -6 mol/min em relação a H2, é correto afirmar que a velocidade em relação a O2 é igual a -3 mol/min.
Considere que a reação química apresentada a seguir tenha ocorrido em meio aquoso, e que a velocidade dessa reação e a extensão na qual ela procede, para direita, podem ser prontamente avaliadas pela observação da cor vermelho-alaranjada do íon triiodeto I3- (os outros participantes da reação são incolores).
H3AsO4 + 3I- + 2H+ ↔ H3AsO3 + I-3 + H2O
Considerando essas informações, julgue o item subsecutivo.
Se 1 mmol de ácido arsênico, H3AsO4, for adicionado a 100 mL de solução contendo 3 mmol de iodeto de potássio, a cor vermelho-alaranjada aparecerá quase que imediatamente.
Considere que a reação química apresentada a seguir tenha ocorrido em meio aquoso, e que a velocidade dessa reação e a extensão na qual ela procede, para direita, podem ser prontamente avaliadas pela observação da cor vermelho-alaranjada do íon triiodeto I3- (os outros participantes da reação são incolores).
H3AsO4 + 3I- + 2H+ ↔ H3AsO3 + I-3 + H2O
Considerando essas informações, julgue o item subsecutivo.
A constante de equilíbrio da reação apresentada pode ser corretamente expressa como