Questões de Concurso Sobre química
Foram encontradas 13.580 questões
1) C6H6 + HNO3 → C6H5NO2 + H2O
2) CH5CH=CH2 + Cl2 → CH3-CHClCH2Cl
3) CH3CH=CHCH2CO2H → CH3CH2-CH=CH2 + CO2
4) CH3CH2CH2S + (CH3)2+ CH3NH2 → CH3CH2CH2N+ H2CH3 + (CH3)2S
1 - A quantidade de luz absorvida é dada pela expressão da lei de absorção de Lambert-Beer.
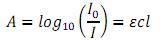
A = absorvância.
e = coeficiente de absortividade molar.
c = concentração molar da substância.
l = comprimento da cubeta em cm.
2 - Cada substância tem um e (coeficiente de absortividade molar) característico.
3 - A absorvância pode ser medida a qualquer temperatura.
4 - A absorvância medida independe do comprimento de onda usado.
é correto afirmar que
1 - o soluto tenha uma boa solubilidade a frio e baixa solubilidade a quente;
2 - o soluto tenha uma baixa solubilidade a frio e alta solubilidade a quente;
3 - as contaminações por adsorção podem ser removidas por lavagem com o solvente de cristalização;
4 - as contaminações por oclusão são removidas por recristalizações sucessivas.
Verifica-se que
1 - O processo de extração por Soxhlet é considerado um processo contínuo.
2 - O processo de extração por Soxhlet é útil para extração pois o solvente é reciclado na amostra fazendo uma extração exaustiva e completa.
3 - Na separação de misturas podemos utilizar a extração por solvente, extração por fluído em fase supercrítica, precipitação e técnicas cromatográficas.
4 - Na extração por solvente a separação do soluto entre ambas as fases é dado pela lei de partição de Nernst que é expressa como o coeficiente de distribuição
KD = [ A ]0 / [ A ]aq
onde [A]0 e [A]aq representam as concentrações do soluto A na fase orgânica e aquosa respectivamente.
verifica-se que
1- a coluna tenha um grande número de pratos teóricos;
2- que a altura do prato teórico seja pequeno;
3- que a diferença de ponto de ebulição entre os constituintes da mistura seja grande.
Quanto às três afirmativas, podemos afirmar:
Dados: C = 12; H = 1; O = 16
Dados: C = 12; H = 1; R = 0.082 atm.L.mol -1 .K-1
I. A pressão parcial do metano é 0,6 atm.
II. A pressão total é 3,44 atm.
III. A fração em mol do butano é aproximadamente 0,5.
IV. A pressão parcial do propano é 0,615 atm.
V. A quantidade de matéria do propano é 0,11 mol.
verifica-se que estão corretas
I. Quanto maior a constante de ionização de um ácido, mais forte será esse ácido.
II. Em um ácido poliprótico, a remoção do 2º hidrogênio é bem mais fácil que o 1º hidrogênio.
III. Quanto menor o valor da constante de ionização maior a tendência de liberar H+ .
IV. Para poliácidos o valor da primeira constante de ionização é maior que o da segunda constante.
verifica-se que estão corretas
I. A constante a está relacionada com as forças de atração intermoleculares.
II. A constante a está relacionada com o volume das moléculas fazendo com que o produto PV seja maior que o ideal.
III. A constante b está relacionada com o volume das moléculas e faz com que o produto PV seja maior que o ideal.
IV. Em pressões elevadas, os termos ( a/V ) e ( ab/ V2), que são grandezas aproximadamente iguais e de sinais opostos, podem ser ignorados na equação.
V. Em pressões elevadas, os termos bP e ( ab/ V 2) tornam-se desprezíveis. verifica-se que estão corretas
verifica-se que estão corretas
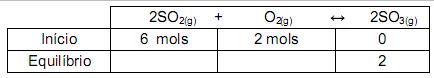
após determinação das lacunas em branco na tabela, o valor da constante de equilíbrio é
Dado: F = 19
Fe3O4(s)+ 4 H2(g)↔ 3 Fe(s)+ 4 H2(g) ΔH = -209,5 kcal.mol -1
e considerando as afirmações seguintes,
I. A adição de um catalisador desloca o equilíbrio para direita.
II. O aumento da pressão desloca o equilíbrio para a esquerda.
III. A diminuição da temperatura desloca o equilíbrio para a direita.
IV. A diminuição da pressão desloca o equilíbrio para a direita.
V. O aumento da temperatura desloca o equilíbrio para a esquerda.
verifica-se que está(ão) correta(s)
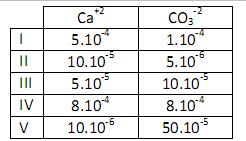
Dessa forma, podemos afirmar que
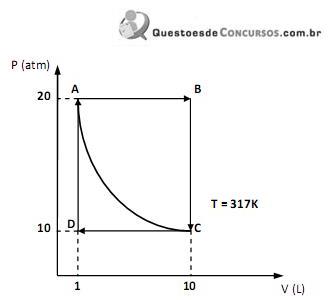
Hg(l) + ½ O2(g) → HgO(s)ΔH = - 90KJ.mol -1
na formação de 72g de HgO(s), ocorre
Dados: Hg = 200; O = 16
I. NH3(aq)+ H2O(l)→ NH4+(aq)+ OH¯(aq)
II. Fe2O3(s)+ 2Al(s) → 2Fe(l) + Al2O3(s)
III. 2K(s) + 2H2O(l) → 2KOH(aq)+ H 2(g)
IV. 2H2S(g)+ 4Ag(s) + O2(g)→ 2Ag2S(s)+ 2H2O(l)
São reações de oxidação-redução:
I. Cloreto de potássio.
II. Carbonato de sódio.
III. Cloreto de amônio.
IV. Acetato de sódio.
V. Fluoreto de lítio.
quais as soluções aquosas dos sais referidos que vão apresentar um pH acima de 7?