Questões de Concurso Sobre química
Foram encontradas 13.580 questões
O esquema apresentado a seguir descreve a sequência de operações realizadas por um técnico de laboratório para extrair os constituintes químicos de um material biológico e indica as fórmulas estruturais das substâncias químicas utilizadas pelo técnico.

O esquema apresentado a seguir descreve a sequência de operações realizadas por um técnico de laboratório para extrair os constituintes químicos de um material biológico e indica as fórmulas estruturais das substâncias químicas utilizadas pelo técnico.

Classifica-se uma reação de eletrólise como uma reação de
Um estudante investigou as propriedades físicas e químicas de um gás e em seguida preparou um relatório, no qual anotou o seguinte:
1. O gás é incolor e inodoro.
2. Quando borbulhado em um frasco contendo água de cal, (solução de hidróxido de cálcio), a solução fica turva, devido à formação de um precipitado branco leitoso.
3. Quando borbulhado em um frasco contendo água destilada, a solução resultante é levemente ácida.
4. O gás extingue a chama de uma vela acesa.
5. O gás é o dióxido de carbono.
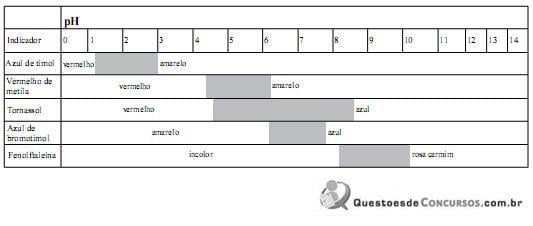
Considere que uma solução levemente ácida apresenta, a 25 ºC, variação de uma unidade de pH em relação à solução neutra (pH 7,0).
Para confirmar a informação referente à baixa acidez da solução conforme descreve o item 3 do relatório, o indicador mais adequado é
Um estudante investigou as propriedades físicas e químicas de um gás e em seguida preparou um relatório, no qual anotou o seguinte:
1. O gás é incolor e inodoro.
2. Quando borbulhado em um frasco contendo água de cal, (solução de hidróxido de cálcio), a solução fica turva, devido à formação de um precipitado branco leitoso.
3. Quando borbulhado em um frasco contendo água destilada, a solução resultante é levemente ácida.
4. O gás extingue a chama de uma vela acesa.
5. O gás é o dióxido de carbono.
Dos mais de 100 elementos químicos que compõem a Tabela Periódica, vinte e um exercem papel vital no organismo humano.
Aparecem de forma combinada nas mais variadas substâncias e participam das reações químicas que ocorrem no organismo, desempenhando diferentes funções. A tabela a seguir reúne os elementos químicos que ocorrem no corpo humano.

concentração de NaCl, em mol/L, no corpo de um adulto corresponde aproximadamente a
Dos mais de 100 elementos químicos que compõem a Tabela Periódica, vinte e um exercem papel vital no organismo humano.
Aparecem de forma combinada nas mais variadas substâncias e participam das reações químicas que ocorrem no organismo, desempenhando diferentes funções. A tabela a seguir reúne os elementos químicos que ocorrem no corpo humano.

De acordo com a fórmula, o trifosfato de cálcio é constituído pela combinação de átomos em proporções definidas, à custa de ligações
Dos mais de 100 elementos químicos que compõem a Tabela Periódica, vinte e um exercem papel vital no organismo humano.
Aparecem de forma combinada nas mais variadas substâncias e participam das reações químicas que ocorrem no organismo, desempenhando diferentes funções. A tabela a seguir reúne os elementos químicos que ocorrem no corpo humano.

Uma amostra contendo 2 g de um cereal enriquecido com ferro (II) foi transferida para um frasco contendo solução aquosa de ácido sulfúrico e em seguida titulada com solução padronizada de KMnO4 , conforme descrito na literatura. A equação iônica da titulação está representada a seguir:
MnO4 – (aq) + 8H+ (aq) + 5Fe2+ (aq) ? Mn2+ (aq) + 4H2 O (l) + 5Fe3+ (aq)
Terminada a titulação, calculou-se que foram consumidos 0,00075 mol de KMnO4 . Sabendo que a massa molar do Fe é 56 g/mol, a quantidade, em g de ferro (II) na amostra analisada é
Dos mais de 100 elementos químicos que compõem a Tabela Periódica, vinte e um exercem papel vital no organismo humano.
Aparecem de forma combinada nas mais variadas substâncias e participam das reações químicas que ocorrem no organismo, desempenhando diferentes funções. A tabela a seguir reúne os elementos químicos que ocorrem no corpo humano.

(Dados: C = 12 / H = 1 e O = 16)
(Dados: C=12 / H=1 e O = 16)
A perda por calcinação, expressa em percentual de CO2 na amostra original é de:
I o azul de timol em pH acima de 2,8 tem a cor vermelha.
II o vermelho de metila em pH acima de 6,2 tem a cor vermelha.
III o amarelo de alizarina em pH acima de 11,0 tem a cor violeta.
IV o alaranjado de metila em pH abaixo de 3,1 tem a cor vermelha.
V o tornassol tem a cor vermelha em pH abaixo de 4,5.
Das afirmativas acima, estão INCORRETAS:
(Dados: potencial padrão de oxidação do zinco = +0,76v / potencial padrão de oxidação do cobre = -0,34v / Zn = 65,5 e Cu = 63,5)
(Dado: densidade da solução =1 e I = 127)