Questões de Concurso Sobre química
Foram encontradas 13.580 questões
Qual é, aproximadamente, o volume, em L, ocupado por essa massa de 13 kg?
Dado: Kps (CaF2 ) = 3,9 x 10-11

É(São) correta(s) apenas a(s) assertativa(s)
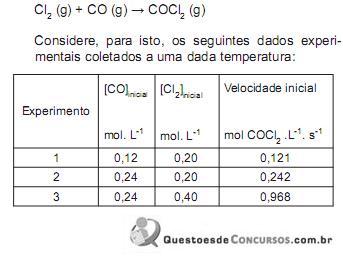
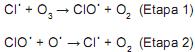
Em relação à atuação do catalisador e o mecanismo acima, julgue os itens a seguir.

É(São) correta(s) a(s) assertiva(s)
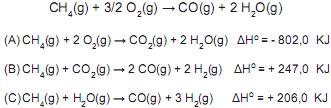
Dado: R = 0,082 atm.L.mol -1 .K-1
I. A lei dos gases ideais representada pela expressão PV= nRT pode ser usada para gases reais em baixas pressões.
II. O fator de compressão, Z, de um gás é a razão do volume molar do gás e o volume molar de um gás ideal nas mesmas condições. Portanto um gás ideal deveria apresentar Z=0, pois não há qualquer interação entre suas moléculas.
III. A equação do virial é uma equação geral usada para descrever gases reais e leva em consideração as forças de atração e repulsão intermoleculares.
IV. A equação de van der Waals é uma equação de estado aproximada de um gás real, que independente da temperatura, inclui parâmetros relacionados apenas com as forças de atração.
É(São) correta(s) apenas a(s) assertiva(s)
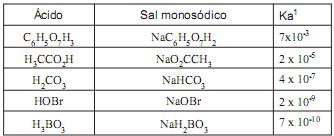
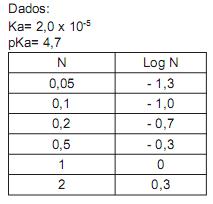
Com base nos valores da constante de equilíbrio da primeira dissociação ácida em meio aquoso (Ka1 ) dos ácidos listados, um dos pares ácido/ sal monosódico foi escolhido para a preparação da solução tampão. Desta forma, massa correspondente a 0,16 mol do sal monosódico foi pesada e transferida quantitativamente para um balão volumétrico de 1 litro. Para se obter 1 litro da solução tampão desejada, a massa do ácido pesada e transferida quantitativamente para o balão volumétrico contendo o sal monosódico deve ser
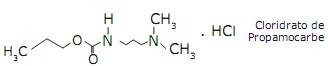
A massa do sal Cloridrato de Propamocarbe necessária para preparar 10 L de uma solução do Propamocarbe na sua forma de Base Livre com concentração 0,1 mol/L é
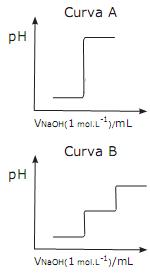
Curva A e Curva B correspondem respectivamente à titulação ácido/base de soluções dos ácidos
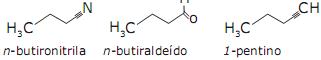
A ordem crescente de ponto de ebulição para estas substâncias é