Questões de Concurso Sobre química
Foram encontradas 13.691 questões
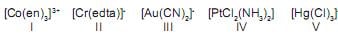
A única opção que apresenta os compostos de coordenação que têm o mesmo número de coordenação é:
Dados: en = etilenodiamina;
edta = etilenodiaminotetracetato
As fibras sintéticas são obtidas a partir de polímeros cujos monômeros ligam-se por reações de condensação, por isso, são chamados polímeros de condensação. O dracon, um exemplo de fibra sintética, é produzido pela esterificação do ácido tereftálico com etilenoglicol.
I:2NiS+3O2 → 2NiO+2SO2
II:NiO+C→ Ni+CO
Duas toneladas de um minério contendo NiS foram processadas,obtendo-se 293,5gramasdeNíquel metálico. O percentualaproximadodeNiSnominérioprocessadofoide:
Considerando esse caso hipotético e que a massa molar do H2 é 2,00 g.mol-1 e o valor da constante universal dos gases é 0,082 J.mol-1 .K-1 , os valores do calor de combustão, ΔU, por massa e por mol são, respectivamente:
Considerando esse caso hipotético e que a massa molar do H2 é 2,00 g.mol -1 e o valor da constante universal dos gases é 0,082 J.mol -1 .K-1 , os valores do calor de combustão, ΔU, por massa e por mol são, respectivamente:
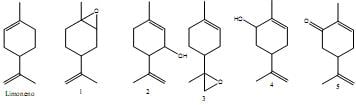
Sobre as estruturas mostradas acima, assinale a alternativa incorreta.
Dados:
Massa Atômica do Na = 23
Massa Atômica do S = 32
Massa Atômica do O = 16
Dentre os sistemas abaixo, o único que NÃO é uma dispersão é
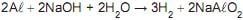
A quantidade de gás hidrogênio, em mol, obtido, nesse experimento, é, aproximadamente,
O potencial de redução padrão do zinco em relação ao eletrodo de referência de Ag/AgCl é
Considerando que as medições foram feitas dentro da faixa de resposta linear, definida pela lei de Beer, e que a absorvância medida na solução diluída foi metade do valor da medida na solução original, a razão entre as concentrações da solução original e a solução diluída é