Questões de Concurso
Comentadas sobre sistemas homogêneos: equilíbrio químico na água: ph e poh, indicadores ácido-base, solução tampão. em química
Foram encontradas 322 questões

Considere os dados da tabela abaixo:

De acordo com os dados acima, o ânion que atua como base mais forte é:
Dados: log 2 = 0,3 e log 3 = 0,48
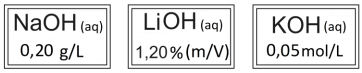
Considerando que todas as bases têm 100% de dissociação iônica e que o técnico precisa organizar as garrafas em ordem decrescente dos valores de pH, assinale a alternativa que indica a ordem correta das garrafas.
Massas molares em g/mol: H = 1; O = 16; Li = 7; Na = 23; K = 39
O reagente de Nessler é uma solução alcalina de tetraiodomercurato de potássio que, ao reagir com o radical amônia, forma um complexo de coloração amarela e fórmula HgI2.HgNH2I. A carne em início de deterioração e que apresente cor amarela neste teste deverá ter nível de pH
Comparando soluções de mesma concentração das substâncias abaixo, assinale qual possuirá o pH mais ácido:
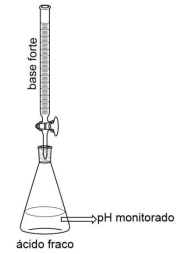
Muitos aquíferos apresentam capacidade tamponante. Em alguns deles, essa característica se deve ao equilíbrio do HCO3- e do CO3- . Caso esse equilíbrio esteja presente, em uma situação tal que [CO3- ]=0,048 mol/L e [HCO3- ]=0,80 mol/L, e sabendo que pKa2 do H2CO3 é igual a 10,25, assinale a opção que apresenta a faixa de valores em que se encontra o pH dessa solução-tampão, sabendo que log0,06 = -1,25.
Em uma amostra de água a medida do pH foi de 3. Pode-se afirmar que a amostra tem caráter:
Um aluno saiu para fazer as compras do mês de junho num mercado do bairro. Ele levou em seu poder uma lista de compras deixada pela sua mãe. A mãe deste aluno também era professora de ciências e para avaliar o seu conhecimento sobre pH deixou a seguinte frase na lista: Hoje você só precisa comprar produtos ácidos. Diante disso, marque a alternativa abaixo que apresenta apenas produtos ácidos.
A química está presente em todos os momentos do nosso cotidiano. Mesmo sem percebermos ela faz parte de nossas vidas. Desde as coisas mais complexas como a transferência energética dentro de nossas células até as coisas mais simples como rasgar uma folha de papel, ferver a água ou quebrar um copo. Marque a alternativa que descreve o que está ocorrendo com as coisas ditas mais simples.