Questões de Concurso
Comentadas sobre soluções e substâncias inorgânicas em química
Foram encontradas 495 questões
Ao se misturarem 30 g da solução de 92 °INPM com 50 g da solução de 70 °INPM, é obtida uma solução de etanol com concentração maior que 80 °INPM.
A concentração, em quantidade de matéria, da solução de 70 °INPM é maior que 13 mol/L.
A solução de álcool de 92 °INPM é uma solução supersaturada, a de 70 °INPM é uma solução saturada, e a de 46 °INPM é uma solução insaturada.
O gráfico seguinte mostra um diagrama de fases genérico de uma substância pura.

O fato de o NaCl fundir-se a 801 °C e o MgO fundir-se a 2.852 °C é uma evidência de que os sólidos iônicos são unidos por interações entre cátions e ânions, isto é, ligações iônicas.
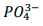 foi precipitado como Ag3PO4 a partir da adição
de 20mL de AgNO3 0,4mol.L-1. O excesso de AgNO3 foi retrotitulado com 5,2 mL de KSCN 0,17 mol.L-1. A
porcentagem aproximada de fósforo na amostra de
fertilizante é
[Ma(u): Ag = 108; K = 39; S = 32; P = 31; O = 16; N= 14; C =
12]:
foi precipitado como Ag3PO4 a partir da adição
de 20mL de AgNO3 0,4mol.L-1. O excesso de AgNO3 foi retrotitulado com 5,2 mL de KSCN 0,17 mol.L-1. A
porcentagem aproximada de fósforo na amostra de
fertilizante é
[Ma(u): Ag = 108; K = 39; S = 32; P = 31; O = 16; N= 14; C =
12]: Julgue o item quanto à química inorgânica e aos compostos inorgânicos.
O bário é um elemento capaz de formar o sulfato de
bário (BaSO4), que praticamente não se dissolve em água
e é aplicado como pigmento branco e como contraste
em diagnósticos radiológicos.
Julgue o item quanto à química inorgânica e aos compostos inorgânicos.
O carbonato de cálcio é o principal componente do
minério calcário e, quando aquecido a uma temperatura
alta, decompõe‐se para formar cal virgem (óxido de
cálcio sólido, CaO) e dióxido de carbono gasoso.
Julgue o item quanto à química inorgânica e aos compostos inorgânicos.
Por causa da elevada afinidade do alumínio com o
oxigênio, as superfícies de alumínio são recobertas com
uma fina camada de óxido de alumínio, cuja fórmula é
Al3O2.
HCI (aq) + KOH (aq) → KCI (aq) + H2O (I)
Após os cálculos, esse pós-graduando concluiu que o pH da solução resultante é igual a:
Dados: αHCl = 100%, Log 5 = 0,7 Massas Molares em g/mol: H = 1; O = 16; Cl = 35,5; K=39,1
Dados: Massas Molares (em g/mol): H=1; C=12; O=16
Dados: Massas Molares (em g/mol): H=1; C=12; O= 16
P2O5(S) + 9 H2O(I) → 2PO43- (aq) + 6 H3O+(I)
2 PO43-(aq) + 6 Ag+(aq) → 2 Ag3PO4(S)
Ag+(aq) + SCN-(aq) → AgSCN(s)
Sendo assim, a porcentagem de P2O5 presente na amostra é, aproximadamente, igual a:
Dados: Massas molares em g/Mol C = 12,01 N = 14,00; O = 16,00; P = 30,97; S = 32,06; Ag = 107,87
1- Compostos de Pt(II) e Pt(IV) ( ) Úlceras Gástricas
2- Compostos de Au(I) ( ) Malária
3- Salicilatos de Bismuto(III) ( ) Tumores diversos
4- Compostos de Li(I) 5- Ferroquina ( ) Transtorno de humor
Marque a sequência correta.
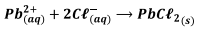
Admite-se que os íons Pb2+ foram consumidos em sua totalidade formando cloreto de chumbo(Il). O excesso de ácido é titulado com solução 0,1 mol.L-1 de hidróxido de sódio (NaOH), consumindo 30mL da base.
O teor (em base mássica) de ions Pb2+ na amostra de efluente, expresso em porcentagem, é aproximadamente iguala:
[Ma(u): Pb = 207; Cl 35,5; Na=23;0=16;H=1]
Um técnico coletou uma alíquota de 200mL dessa última solução e adicionou 600mL de solução aquosa de NaCl 0,5 mol.L-1. A concentração de K2CO3, em mol.L-1, na solução salina preparada pelo técnico corresponde a:
[Ma(u): K = 39; Cl 35,5; Na = 23; 0= 16; C = 12]
[Ma(u): Ba =137;0=16;N=14;H=1]