Questões de Concurso
Comentadas sobre soluções e substâncias inorgânicas em química
Foram encontradas 1.220 questões
As4O6 + 6 H2O 4 H3AsO3
H3AsO3 + I3- + H2O H3AsO4 + 3 I- + 2 H+ →→
Calcule a molaridade da solução de I3¯.
Para produzir 25,0 mL de solução aquosa de ibuprofeno com concentração igual a 0,50 mol/L, é necessário usar uma massa inferior a 2,0 g desse medicamento.
A adição de sal light à água, para o preparo de macarrão, diminui a temperatura de ebulição e aumenta a pressão máxima de vapor d’água, por isso ela ferveria mais rápido nessas condições.
A partir do texto apresentado, e considerando que as massas molares do NaCl e do KCl valham, respectivamente, 58,5 g/mol e 74,6 g/mol e que a constante de Avogadro valha 6 × 1023 mol−1, julgue o item a seguir.
A solução de sal light é classificada como eletrolítica e a sua
condutibilidade elétrica é tão maior quanto menor for a sua
concentração.
A partir do texto apresentado, e considerando que as massas molares do NaCl e do KCl valham, respectivamente, 58,5 g/mol e 74,6 g/mol e que a constante de Avogadro valha 6 × 1023 mol−1, julgue o item a seguir.
A concentração de íons Cl−
na solução de sal light preparada
conforme o texto é inferior a 0,05 mol/L.
A partir do texto apresentado, e considerando que as massas molares do NaCl e do KCl valham, respectivamente, 58,5 g/mol e 74,6 g/mol e que a constante de Avogadro valha 6 × 1023 mol−1, julgue o item a seguir.
Na solução de sal light preparada conforme o texto, estão
contidos 1,2 × 1022 íons de Na+
.
1. Básicos 2. Ácidos 3. Neutros 4. Peróxidos 5. Anfóteros
( ) Em solução aquosa reagem com a água ou ácidos diluídos e formam água oxigenada. ( ) Em solução aquosa alteram o pH para maior que 7. ( ) Em solução aquosa reagem com a água e formam ácidos. ( ) Podem se comportar como ácidos ou bases. ( ) Não reagem com a água.
Assinale a alternativa que apresente a relação correta, de cima para baixo.
Reações de neutralização são reações entre um ácido e uma
base que produzem sal e água, de acordo com os conceitos de
Arrhenius. O sal inorgânico formado é então um produto iônico
dessa reação que ao ter contato com a água é dissolvido liberando
no mínimo um cátion diferente de H+ e no mínimo um ânion
diferente de OH-. Considerando a dissolução de um sal em uma
solução aquosa neutra, assinale a alternativa correta.
As figuras a seguir ilustram quatro curvas de titulação volumétrica de neutralização (A, B, C e D), envolvendo ácidos e bases de concentrações iguais.
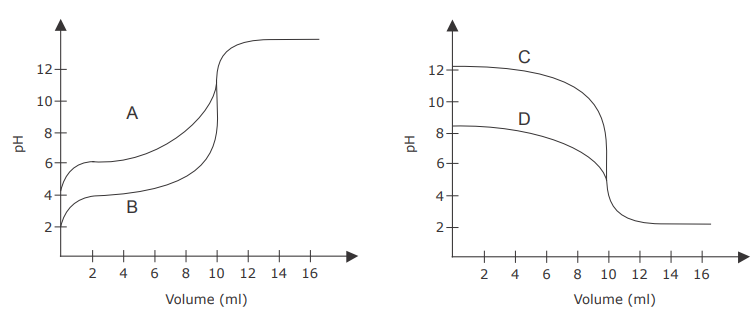
Em relação às curvas de titulação da figura, assinale V (verdadeiro) ou F (falso) em cada afirmativa a seguir.
( ) A curva "A" representa a titulação de um ácido fraco com uma base forte.
( ) A curva "B" representa a titulação de um ácido muito fraco com uma base forte.
( ) A curva "C" representa a titulação de uma base fraca com um ácido forte.
( ) A curva "D" representa a titulação de um ácido fraco com uma base forte.
A sequência correta é